题目内容
【题目】回答下列问题
(1)以电石制取乙炔时,用硫酸铜溶液除去其中的H2S气体,该反应方程式为____________________________
(2)在检验溴乙烷中的溴元素时,在加入NaOH溶液加热,冷却后,加入_______________________,若产生浅黄色沉淀,说明溴乙烷中含有溴元素。
(3)某同学设计了由乙醇合成乙二醇的路线如下。下列说法正确的是

步骤①的反应类型是________________________;步骤②需要的试剂是_________________________
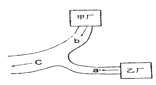
(4)为了证明酸性:CH3COOH>H2CO3>C6H5OH,如图装置存在严重缺陷,请说明原因,并提出改进方案。

① 原因:______________________________________________________________
② 改进方案:___________________________________________________________
③ 改进后,装置乙中发生反应的化学方程式为:___________________________________________________
【答案】H2S+CuSO4=CuS↓+H2SO4 稀硝酸酸化后,再加入适量AgNO3溶液 消去反应 NaOH、H2O 挥发出的CH3COOH也能使苯酚钠溶液变浑浊,干扰H2CO3和C6H5OH酸性的比较 在甲、乙装置之间增加一个盛有NaHCO3溶液的洗气瓶,除去CH3COOH ![]()
【解析】
本题主要考查卤代烃中溴元素的检验,乙酸、碳酸、苯酚酸性强弱的比较,特别需要排除干扰因素。
(1)电石中含有CaS等杂质,与水反应得到的乙炔中混有H2S。因CuS的溶度积很小,H2S与CuSO4能发生复分解反应,生成强酸H2SO4,反应的化学方程式为H2S+CuSO4=CuS↓+H2SO4。
(2)溴乙烷是共价化合物,不会电离出溴离子。与NaOH溶液共热后,溴原子变成溴离子。在用AgNO3溶液检验溴离子前,应先用硝酸酸化,以防OH-与Ag+生成沉淀,干扰观察AgBr颜色。
(3)X能与Br2的CCl4溶液反应,即X中有不饱和键,反应①消去反应。从而X为CH2=CH2,Y为BrCH2CH2Br。Y与NaOH水溶液共热,发生水解反应生成乙二醇。
(4)甲中加入醋酸溶液后有大量气泡产生,说明酸性CH3COOH>H2CO3;甲中生成的CO2中混有醋酸蒸气,醋酸也能使苯酚钠溶液变浑浊。故乙中苯酚钠溶液变浑浊不能说明酸性H2CO3>C6H5OH。可在甲、乙之间增加盛有饱和NaHCO3溶液的洗气瓶,以除去CH3COOH。不含CH3COOH的CO2与苯酚钠溶液发生复分解反应,只能生成NaHCO3,而不能生成Na2CO3,CO2与苯酚钠反应的化学方程式为CO2+H2O+C6H5ONa→C6H5OH+NaHCO3。