题目内容
【题目】根据所学电化学知识,回答下列问题:
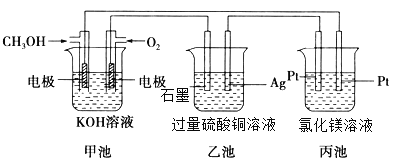
(1)①甲池中通入CH3OH的电极名称是________极,写出其电极反应式_______;乙池中石墨电极反应式为_______;丙池中反应的离子方程式为_______;
②反应一段时间后,甲池中消耗560mL(标准状况下)O2,此时乙池溶液的pH=_______;若向乙池中加入_______,其质量为_______g,能使CuSO4溶液恢复到原浓度(假设电解前后溶液的体积不变,均为100mL)。丙池中理论上最多产生_______g固体。
(2)工业上以石墨为电极,电解CuCl2溶液时,发现阴极上也会有CuCl析出,写出此过程中阴极上的电极反应式____________________________。
【答案】负极 CH3OH-6e-+8OH-=CO32-+6H2O 4OH--4e-=O2↑+2H2O Mg2++2Cl-+2H2O![]() Mg(OH)2↓+H2↑+Cl2↑ pH=0 CuO 4g 2.9g Cu2++e-+Cl=CuCl
Mg(OH)2↓+H2↑+Cl2↑ pH=0 CuO 4g 2.9g Cu2++e-+Cl=CuCl
【解析】
(1)①燃料电池中可燃物作为负极材料失去电子,CH3OH发生氧化反应,所以该电极是负极,反应式为:CH3OH-6e-+8OH-=CO32-+6H2O;乙池为以甲池为外加电源的电解池,石墨电极连接正极,为阳极氢氧根离子放电,电极反应式为:4OH--4e-=O2↑+2H2O;丙池为惰性电极电解氯化镁溶液,反应的离子方程式为:Mg2++2Cl-+2H2O![]() Mg(OH)2↓+H2↑+Cl2↑;②反应一段时间后,甲池中消耗560mL(标准状况下)O2,为
Mg(OH)2↓+H2↑+Cl2↑;②反应一段时间后,甲池中消耗560mL(标准状况下)O2,为![]() =0.025mol,根据反应O2+4e-+2H2O =4OH-,则转移电子的物质的量为0.025mol×4=0.1mol,根据乙池是电极反应4OH--4e-=O2↑+2H2O,则溶液中产生氢离子的物质的量为0.1mol,浓度为
=0.025mol,根据反应O2+4e-+2H2O =4OH-,则转移电子的物质的量为0.025mol×4=0.1mol,根据乙池是电极反应4OH--4e-=O2↑+2H2O,则溶液中产生氢离子的物质的量为0.1mol,浓度为![]() =1mol/L,则pH=0;乙池中总反应式为2CuSO4+2H2O
=1mol/L,则pH=0;乙池中总反应式为2CuSO4+2H2O ![]() 2Cu+2H2SO4+O2↑,若向乙池中加入CuO,物质的量为氧气的2倍,其质量为2×0.025mol×80g/mol=4g,能使CuSO4溶液恢复到原浓度;根据丙装置中,在阳极上是氢离子放电,所以镁离子和氢氧根离子之间反应生成氢氧化镁,理论上最多产生氢氧化镁0.1mol×58g/mol=2.9g固体;(2)工业上以石墨为电极,电解CuCl2溶液时,发现阴极上也会有CuCl析出,过程中铜离子得电子产生CuCl,阴极上的电极反应式为:Cu2++e-+Cl-=CuCl。
2Cu+2H2SO4+O2↑,若向乙池中加入CuO,物质的量为氧气的2倍,其质量为2×0.025mol×80g/mol=4g,能使CuSO4溶液恢复到原浓度;根据丙装置中,在阳极上是氢离子放电,所以镁离子和氢氧根离子之间反应生成氢氧化镁,理论上最多产生氢氧化镁0.1mol×58g/mol=2.9g固体;(2)工业上以石墨为电极,电解CuCl2溶液时,发现阴极上也会有CuCl析出,过程中铜离子得电子产生CuCl,阴极上的电极反应式为:Cu2++e-+Cl-=CuCl。

【题目】金属加工前常用盐酸对金属表面氧化物进行清洗,会产生酸洗废水。pH在2左右的某酸性废水含铁元素质量分数约3%,其他金属元素如铜、镍、锌浓度较低,综合利用酸洗废水可制备三氯化铁。制备过程如下:
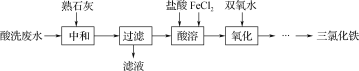
相关金属离子生成氢氧化物沉淀的pH如下表:
Fe(OH)3 | Cu(OH)2 | Ni(OH)2 | Zn(OH)2 | |
开始沉淀的pH | 1.5 | 4.2 | 7.1 | 5.4 |
沉淀完全的pH | 3.7 | 6.7 | 9.2 | 8.0 |
回答下列问题:
(1)“中和”时调节pH至________,有利于后续制备得纯度较高的产品。
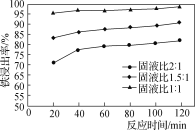
(2)处理酸洗废水中和后的滤渣,使铁元素浸出。按照不同的固液比投入“过滤”后滤渣和工业盐酸进行反应的铁浸出率如图所示,实际生产中固液比选择1.5∶1的原因是__________________。
(3)写出“氧化”中发生反应的离子方程式:____________________________________。
(4)“酸溶”后需根据溶液中Fe2+含量确定氧化剂的投入量。用K2Cr2O7标准溶液测定Fe2+(Cr2O![]() 被还原为Cr3+)的含量,该反应离子方程式为____________________________。
被还原为Cr3+)的含量,该反应离子方程式为____________________________。
(5) 将三氯化铁溶液在一定条件下________、________、过滤、洗涤、在氯化氢气氛中干燥得FeCl3·6H2O晶体,在实验室过滤装置中洗涤固体的方法是___________________。