��Ŀ����
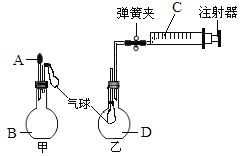
����Ŀ����1��Ϊ���о���ѧ��ӦA+B�TC+D�������仯�����ijͬѧ�������ͼ��ʾװ�ã�����ʢ��A���Թ��еμ��Լ�Bʱ������U�ι��м״�Һ���½��Ҵ�Һ���������Իش��������⣺
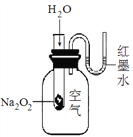
�ٸ÷�ӦΪ__��Ӧ������ȡ������ȡ�����
��A��B����������C��D��������__����ߡ��͡�����
�۷�Ӧ�ﻯѧ���������յ�����__����ߡ��͡����������ﻯѧ���γɷų���������
��2����֪��H2(g)��1/2O2(g)===H2O(g)����Ӧ�����������仯��ͼ��ʾ����
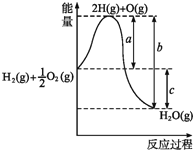
��a��b��c�ֱ����ʲô���壿
a_______________________________________________��
b_______________________________________________��
c_______________________________________________��
�ڸ÷�Ӧ��_________��Ӧ(����ȡ����ȡ�)�� �ų�������Ϊ________kJ(����ĸ��ʾ)
���𰸡� ���� �� �� �ɵĻ�ѧ����������Ҫ������ �µĻ�ѧ���γ����ų������� �ܷ�Ӧ���ų������� ���� c(��b-a)kJ
��������(1)�����ڷ�����ӦA+B�TC+D��U���м״�Һ���½��Ҵ�Һ��������������������������������ʿ����жϸ÷�ӦΪ���ȷ�Ӧ���ʴ�Ϊ�����ȣ�
������A+B�TC+D�ķ�ӦΪ���ȷ�Ӧ������A��B����������C��D���������ߣ��ʴ�Ϊ���ߣ�
�ۻ�ѧ��Ӧ�оɼ����������������¼����ɷų��������÷�ӦΪ���ȷ�Ӧ����Ӧ�ﻯѧ���������յ��������������ﻯѧ���γɷų����������ʴ�Ϊ����
(2)��ͼ�������֪����ѧ��Ӧ����ЧӦʵ���Ƕ��ѻ�ѧ�����յ�������ȥ�γɻ�ѧ���ų�������������a��ʾ�ɵĻ�ѧ����������Ҫ��������b��ʾ�µĻ�ѧ���γ����ų���������c��ʾ�����ܷ�Ӧ���ų����������ʴ�Ϊ���ɵĻ�ѧ����������Ҫ���������µĻ�ѧ���γ����ų����������ܷ�Ӧ���ų���������
�ڷ�Ӧ������������������Ӧ�Ƿ��ȷ�Ӧ���ų�������Ϊc(��b-a)kJ���ʴ�Ϊ�����ȣ�c(��b-a)kJ��

����Ŀ��ij��ѧС��Ϊ���о���������Ի�ѧ��Ӧ���ʵ�Ӱ�죬����������ʵ�飺��ʵ��ԭ����2KMnO4+5H2C2O4+3H2SO4�TK2SO4+2MnSO4+10CO2��+8H2O
��ʵ�����ݼ���¼��
ʵ���� | �����£��Թ��������Լ���������/mL | ��Һ������ɫ����ʱ��/min | |||
0.6mol/L H2C2O4��Һ | H2O | 3mol/L ϡH2SO4��Һ | 0.05mol/L KMnO4��Һ | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
��ش�
��1�����ݱ��е�ʵ�����ݣ����Եõ��Ľ����� ��
��2������ʵ��1�е����ݣ�������KMnO4��ʾ�Ļ�ѧ��Ӧ����Ϊ ��
��3����С��ͬѧ���ݾ��������n��Mn2+����ʱ��仯��������ͼ1��ʾ������ͬѧ�������е�ʵ�����Ϸ��֣���ʵ�������n��Mn2+����ʱ��仯��ʵ��������ͼ2��ʾ��
��С��ͬѧ����ͼ2��ʾ��Ϣ������µļ��裬����������ʵ��̽����
�ٸ�С��ͬѧ����ļ����� ��
�����������С��ͬѧ���ʵ�鷽��������д���пհ�
ʵ���� | �����£��Թ��������Լ��������� | �����Թ��м���ij�ֹ��� | ��Һ������ɫ����ʱ��/min | |||
0.6mol/L H2C2O4��Һ | H2O | 3mol/L ϡH2SO4��Һ | 0.05mol/L KMnO4��Һ | |||
4 | 2.0 | 2.0 | 3.0 | MnSO4 | t | |
������С��ͬѧ����ļ��������Ӧ�۲쵽����