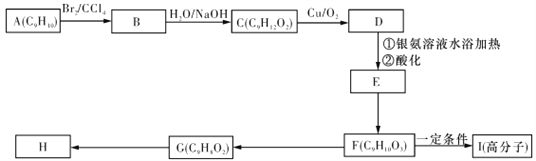
题目内容
【题目】天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式如下,请回答下列问题:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣889.6kJ/mol.
(1)反应物能量总和_____(填“大于”、“小于”或“等于”)生成物能量总和.
(2)若1mol甲烷完全燃烧生成二氧化碳和水蒸气,则放出的热量_____889.6kJ.(填“>”、“<”或“=”)
(3)已知氢气燃烧生成液态水的热化学方程式是:2H2(g)+O2(g)=2H2O(l)△H=﹣572kJ/mol,则相同质量的甲烷和氢气,完全燃烧生成液态水,放热较多的是_____.
(4)被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.
①已知甲烷燃料电池的总反应式为CH4+2O2+2KOH═K2CO3+3H2O,通入甲烷的这个电极是_____(填“正极”或“负极”),其另外一电极上的电极反应式为:__________________.
②通常情况下,甲烷燃料电池的能量利用率_____(填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率.
【答案】 大于 < 氢气 负极 O2+4 e﹣+2H2O = 4 OH﹣ 大于
【解析】(1)已知CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣889.6kJ/mol,反应是放热反应,所以反应物能量总和大于生成物能量总和;正确答案:大于。
(2)水蒸气转化为液态水要放出热量,所以1mol 甲烷完全燃烧生成二氧化碳和水蒸气,放出的热量小于889.6kJ;正确答案:![]() 。
。
(3)已知CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣889.6kJ/mol,2H2(g)+O2(g)=2H2O(l)△H=﹣572kJ/mol,则1g甲烷完全燃烧放出的热量为![]() ,1g氢气完全燃烧放出的热量为
,1g氢气完全燃烧放出的热量为![]() ,所以相同质量的甲烷和氢气,完全燃烧生成液态水,氢气放的热量较多;正确答案:氢气。
,所以相同质量的甲烷和氢气,完全燃烧生成液态水,氢气放的热量较多;正确答案:氢气。
(4) ①碱性甲烷燃料电池中通入甲烷的一极为原电池的负极,负极上甲烷失电子发生氧化反应,电极反应式为![]() ,通入氧气的一极为原电池的正极,极反应为O2+4 e﹣+2H2O =4 OH﹣;正确答案:负极;O2+4 e﹣+2H2O = 4 OH﹣。
,通入氧气的一极为原电池的正极,极反应为O2+4 e﹣+2H2O =4 OH﹣;正确答案:负极;O2+4 e﹣+2H2O = 4 OH﹣。
②通常情况下,甲烷燃料电池的能量利用率大于甲烷燃烧的能量利用率;正确答案:大于。