题目内容
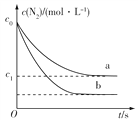
【题目】汽车尾气中NO产生的反应为N2(g)+O2(g) ![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下,N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是( )
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下,N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是( )
A. 在温度T下,该反应的平衡常数K=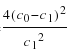
B. 在温度T下,随着反应的进行,混合气体的密度减小
C. 曲线b对应的反应条件改变可能是加入了催化剂
D. 若曲线b对应的反应条件改变是温度,可判断该反应的ΔH<0
【答案】A
【解析】A.N2(g)+O2(g)2NO(g),
起(mol/L) c0 c0 0
转(mol/L) c0 -c1 c0 -c1 2(c0 -c1 )
平(mol/L) c1 c1 2(c0 -c1 )
故K=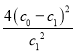 ,故A正确;B.反应前后混合气体质量不变、容器体积不变,则混合气体密度不变,故B错误;C.由图可知,b曲线氮气的平衡浓度减小,故应是平衡发生移动,催化剂只能改变速率,不能改变平衡的移动,故b曲线不可能是由于催化剂造成的,故C错误;D.由图可知,b曲线化学反应速率快(变化幅度大),氮气的平衡浓度减小,升高温度平衡正向移动,则正反应为吸热反应,即△H>0,故D错误;故选A。
,故A正确;B.反应前后混合气体质量不变、容器体积不变,则混合气体密度不变,故B错误;C.由图可知,b曲线氮气的平衡浓度减小,故应是平衡发生移动,催化剂只能改变速率,不能改变平衡的移动,故b曲线不可能是由于催化剂造成的,故C错误;D.由图可知,b曲线化学反应速率快(变化幅度大),氮气的平衡浓度减小,升高温度平衡正向移动,则正反应为吸热反应,即△H>0,故D错误;故选A。

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目