题目内容
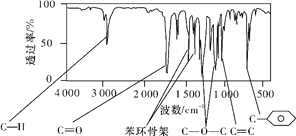
【题目】肉桂酸甲酯(H)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。它的分子式为C10H10O2,且分子中只含有1个苯环,苯环上只有一个取代基。利用红外光谱仪可初步检测有机化合物中的某些基团,现测得H分子的红外光谱如下图所示:
又知J为肉桂酸甲酯的一种同分异构体,其分子结构模型如下图所示(图中球与球之间的连线表示单键或双键等化学键)。

试回答下列问题:
(1)肉桂酸甲酯(H)的结构简式为_______。
(2)现测出A的核磁共振氢谱图有6个峰,且面积之比为1∶2∶2∶2∶1∶2。用芳香烃A为原料合成H的路线如下(部分反应物和反应条件已略去):
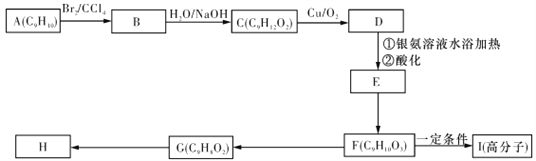
①化合物F中的官能团有__________(填名称)。
②F→G的反应类型是__________。
③书写下列化学方程式:
F→I:____________________。
G→H:_________________________。
④其中F的同分异构体甚多,其中有一类可用通式![]() 表示(其中X、Y均不为氢原子),试写出符合上述通式且能发生银镜反应的四种物质的结构简式:_____________________。
表示(其中X、Y均不为氢原子),试写出符合上述通式且能发生银镜反应的四种物质的结构简式:_____________________。
【答案】 ![]() 羟基、羧基 消去反应
羟基、羧基 消去反应 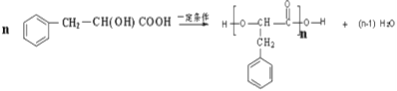
![]()
 ;
; ;
; ;
;
【解析】(1)肉桂酸甲酯的分子式为C10H10O2,肉桂酸甲酯的分子式为C10H10O2,不饱和度为![]() =6,分子中只含有1个苯环,苯环上只有一个取代基,故还含有1个C=C双键,故肉桂酸甲酯的结构简式为:
=6,分子中只含有1个苯环,苯环上只有一个取代基,故还含有1个C=C双键,故肉桂酸甲酯的结构简式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)由A到H的转化结合肉桂酸甲酯的结构特点可知,A含有1个苯环、1个侧链,不饱和度为![]() =5,故侧链中含有1个碳碳双键,A的核磁共振氢谱谱图有6个吸收峰,分子中含有6种H原子,其面积之比为1﹕2﹕2﹕2﹕1﹕2,各种H原子数目为1、2、2、2、1、2,苯环中有3种H原子,分别为1、2、2,故侧链有3种H原子,分别为2、1、2,故侧链中不含甲基,故A的结构简式为
=5,故侧链中含有1个碳碳双键,A的核磁共振氢谱谱图有6个吸收峰,分子中含有6种H原子,其面积之比为1﹕2﹕2﹕2﹕1﹕2,各种H原子数目为1、2、2、2、1、2,苯环中有3种H原子,分别为1、2、2,故侧链有3种H原子,分别为2、1、2,故侧链中不含甲基,故A的结构简式为![]() ,A与溴发生加成反应生成B为
,A与溴发生加成反应生成B为![]() ,B发生水解生成C,结合C的分子式可知,C的结构简式为
,B发生水解生成C,结合C的分子式可知,C的结构简式为![]() ,C发生催化氧化生成D为
,C发生催化氧化生成D为![]() ,D在银氨溶液中反应氧化反应,酸化生成E,E为
,D在银氨溶液中反应氧化反应,酸化生成E,E为![]() ,E反应生成F,由E、F的分子式可知,E中羰基发生加成反应生成F,故F为
,E反应生成F,由E、F的分子式可知,E中羰基发生加成反应生成F,故F为![]() ,结合肉桂酸甲酯的结构可知,F发生消去反应生成G,G与甲醇发生酯化反应生成肉桂酸甲酯,故G为
,结合肉桂酸甲酯的结构可知,F发生消去反应生成G,G与甲醇发生酯化反应生成肉桂酸甲酯,故G为![]() ,G与据此发生酯化反应得到H(肉桂酸甲酯),F发生缩聚反应得到I为
,G与据此发生酯化反应得到H(肉桂酸甲酯),F发生缩聚反应得到I为 。
。
①化合物F为![]() ,官能团有:羧基、羟基,故答案为:羧基、羟基;
,官能团有:羧基、羟基,故答案为:羧基、羟基;
②F-G是![]() 发生消去反应生成
发生消去反应生成![]() ,故答案为:消去反应;
,故答案为:消去反应;
③F-I的反应方程式为: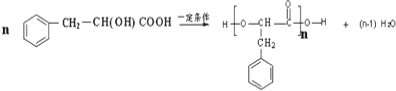 ;
;
G-H的反应方程式为:![]() ,故答案为:
,故答案为: ;
;![]() ;
;
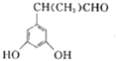
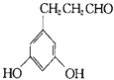
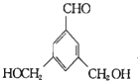
④F(![]() )的同分异构体甚多,其中有一类可用通式
)的同分异构体甚多,其中有一类可用通式![]() 表示(其中X、Y均不为氢),符合上述通式且能发生银镜反应,符合条件的同分异构体有:
表示(其中X、Y均不为氢),符合上述通式且能发生银镜反应,符合条件的同分异构体有: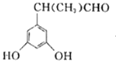 、
、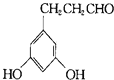 、
、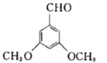 、
、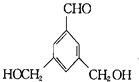 ,故答案为:
,故答案为: ;
; ;
; ;
; 。
。