题目内容
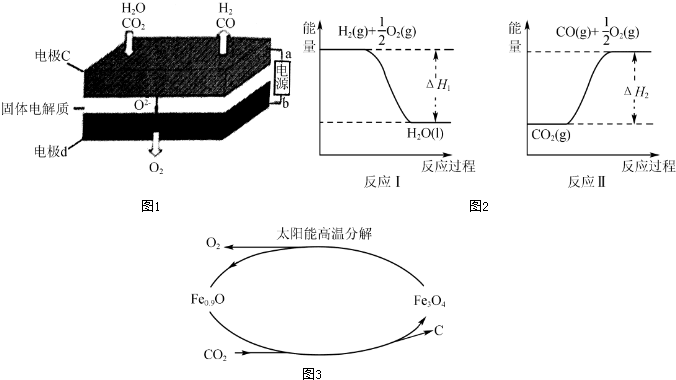
15.如图是部分短周期主族元素原子半径与原子序数的关系图.下列说法错误的是( )
| A. | X、R的最高化合价相同 | |
| B. | 简单离子的半径:X>Y>Z | |
| C. | Y、X、R对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z |
分析 同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,X为O元素,Y为Na元素,Z为Al元素,R为S元素,结合元素周期律与物质的性质等解答.
解答 解:同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,X为O元素,Y为Na元素,Z为Al元素,R为S元素,
A、X为O元素,O元素没有+6价,R为S元素,最高价为+6价,故A错误;
B、X为O元素,Y为Na元素,Z为Al元素,简单离子的半径:O2->Na+>Al3+,故B正确;
C、Y、R对应的最高价氧化物的水化物分别为:NaOH、H2SO4,它们之间可以发生反应,X为O元素,没有最高价氧化物,故C错误;
D、X为O元素,Z为Al元素,电解熔融的Al2O3可以得到单质Al,故D正确;
故选AC.
点评 本题考查位置结构性质的关系及应用,题目难度中等,推断元素是解题的关键,根据原子半径变化规律结合原子序数进行推断,首先审题中要抓住“短周期主族元素”几个字.

练习册系列答案
相关题目
5.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | 苯酚钠溶液与少量二氧化碳反应:2C6H5O-+CO2+H2O→2 C6H5OH+CO32- | |
| C. | 在碳酸氢钠溶液中加入过量的氢氧化钡溶液:Ba2++OH-+HCO3-═BaCO3↓+H2O | |
| D. | 用氯化铁溶液和沸水反应制取氢氧化铁胶体:Fe3++3H2O(沸水)═Fe(OH)3↓+3H+ |
6.下列叙述正确的是( )
| A. | 浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应 | |
| B. | 铜表面易形成致密的氧化膜 | |
| C. | 将CO2通入次氯酸钙溶液可生成次氯酸 | |
| D. | 测定NaOH熔点时,可以将NaOH放入石英坩埚中高温加热 |
10.常温下,下列各组离子在水溶液中能大量共存的是( )
| A. | NH4+,Ag+,NO3-,CO32-,SO42- | B. | Fe2+,H+,NO3-,Cl- | ||
| C. | Al3+、NH4+,HCO3-、Cl- | D. | K+、Na+、NO3-、SO42- |
7.已知aX、bY是元素周期表中除稀有气体外的短周期元素,且a-b=3,X,Y能形成化合物M,下列说法不正确的是( )
| A. | 若X和Y处于同一周期,则X的原子半径肯定小于Y的原子半径 | |
| B. | 若M属于离子化合物,则该化合物中只存在离子键,且每个原子均达到8电子稳定结构 | |
| C. | 若最外层电子数X>Y>2,则X的非金属性一定比Y的非金属性强 | |
| D. | 若X和Y处于同一周期,且M属于共价化合物,则分子中原子个数比可能为1:2 |
4.如表是短周期的一部分.关于这四种主族元素,下列说法正确的是( )
| X | ||
| M | Y | Z |
| A. | 原子半径大小为Z>Y>M>X | |
| B. | 最高价氧化物的水化物的酸性强弱为X>Z>Y>M | |
| C. | 均形成简单离子,简单离子半径大小为M>Y>Z>X | |
| D. | X、M或Y、M不可能同为金属元素 |
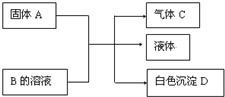 (1)A、B、C、D均为中学化学常见的物质,其组成元素均为主族元素.它们间的反应关系如图所示.
(1)A、B、C、D均为中学化学常见的物质,其组成元素均为主族元素.它们间的反应关系如图所示.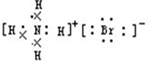 .
.