题目内容
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热,N2使气囊迅速膨胀,从而起到保护作用。
(1)KClO4中氯元素的化合价是___________,具有___________(填“还原性”或“氧化性”)
(2)Fe2O3可处理产生的Na,反应为![]() ,反应中Na做____________(填“还原剂”或“氧化剂”)。
,反应中Na做____________(填“还原剂”或“氧化剂”)。
(3) NaHCO3是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式为____________。
【答案】+7 氧化性 还原剂 2NaHCO3 ![]() Na2CO3 + H2O +CO2 ↑
Na2CO3 + H2O +CO2 ↑
【解析】
(1)氯元素的化合价可由K元素(+1价)和O元素(-2价)的化合价计算得出,根据化合物化合价为0,KClO4中氯的化合价为+7价,答案为+7;+7价为氯的最高价态,所以只能降价表现强氧化性,答案为氧化性;
(2) Na反应前是单质,为0价,反应后Na2O中Na的化合价为+1价,在反应中化合价升高,做还原剂,答案为还原剂;
(3) NaHCO3受热分解,生成Na2CO3、H2O、CO2,答案为:
2NaHCO3 ![]() Na2CO3+H2O+CO2 ↑
Na2CO3+H2O+CO2 ↑

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案【题目】实验小组同学对乙醛与新制的Cu(OH)2反应的实验进行探究。
实验Ⅰ:取2mL 10%的氢氧化钠溶液于试管中,加入5滴2%的CuSO4溶液和5滴5%的乙醛溶液,加热时蓝色悬浊液变黑,静置后未发现红色沉淀。
实验小组对影响实验Ⅰ成败的因素进行探究:
(1)探究乙醛溶液浓度对该反应的影响。
编号 | 实验Ⅱ | 实验Ⅲ |
实验方案 |
|
|
实验现象 | 加热,蓝色悬浊液变红棕色,静置后底部有大量红色沉淀 | 加热,蓝色悬浊液变红棕色,静置后上层为棕黄色油状液体,底部有少量红色沉淀 |
已知:乙醛在碱性条件下发生缩合反应:CH3CHO+CH3CHO![]() CH3CH=CHCHO+H2O ,生成亮黄色物质,加热条件下进一步缩合成棕黄色的油状物质。
CH3CH=CHCHO+H2O ,生成亮黄色物质,加热条件下进一步缩合成棕黄色的油状物质。
① 能证明乙醛被新制的Cu(OH)2 氧化的实验现象是______。
② 乙醛与新制的Cu(OH)2 发生反应的化学方程式是______。
③ 分析实验Ⅲ产生的红色沉淀少于实验Ⅱ的可能原因:______。
(2)探究NaOH溶液浓度对该反应的影响。
编号 | 实验Ⅳ | 实验Ⅴ |
实验方案 |
|
|
实验现象 | 加热,蓝色悬浊液变黑 | 加热,蓝色悬浊液变红棕色, 静置后底部有红色沉淀 |
依据实验Ⅰ→Ⅴ,得出如下结论:
ⅰ. NaOH溶液浓度一定时,适当增大乙醛溶液浓度有利于生成Cu2O。
ⅱ. 乙醛溶液浓度一定时,______。
(3)探究NaOH溶液浓度与乙醛溶液浓度对该反应影响程度的差异。
编号 | 实验Ⅵ | 实验Ⅶ |
实验方案 |
|
|
实验现象 | 加热,蓝色悬浊液变黑 | 加热,静置后底部有红色沉淀 |
由以上实验得出推论: ______。
【题目】某温度下,H2(g)+CO2(g) ![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K= ![]() ,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示,下列判断不正确的是( )
,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示,下列判断不正确的是( )
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/(mol/L) | 0.010 | 0.020 | 0.020 |
c(CO2)(/mol/L) | 0.010 | 0.010 | 0.020 |
A. 平衡时,乙中CO2的转化率大于60%
B. 平衡时,甲中和丙中H2的转化率均是60%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol/L
D. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢
【题目】用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |

(1)该反应的离子方程式 。(已知H2C2O4是二元弱酸)
(2)该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是 < (填实验序号)。
(3)若实验①在2 min末收集了2.24 mL CO2(标准状况下),则在2 min末, c(MnO4-)=__________mol/L(假设混合液体积为50 mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。(一条即可)
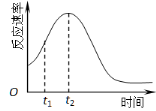 (5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:
(5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:

① ;② 。









