جâؤ؟ؤعبف
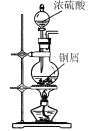
،¾جâؤ؟،؟¶رُ»¯îوCeO2تاز»ضضضطزھµؤد،حءرُ»¯خئ½°هµçتسدشت¾ئءةْ²ْ¹³جضذ²ْةْ´َء؟µؤ·د²£ء§·غؤ©؛¬£¨SiO2،¢Fe2O3،¢CeO2،¢FeOµبخïضت£©،£ؤ³؟خجâ×éزش´ث·غؤ©خھشءد£¬ةè¼ئبçدآ¹¤زصء÷³ج¶ش×تش´½ّذذ»طتص£¬µأµ½´؟¾»µؤCeO2؛حءٍثلجْ茶§جه،£

زرضھ£؛CeO2²»بـسعد،ءٍثل£¬ز²²»بـسعNaOHبـز؛
£¨1£©د،ثلAµؤ·ض×ست½تا_____________________،£
£¨2£©آثز؛1ضذ¼سبëH2O2بـز؛µؤؤ؟µؤتا____________________،£آثشü1ضذ¼سبëد،ثلA؛حH2O2·¢ةْ·´س¦µؤہë×س·½³جتاخھ______________________،£
£¨3£©ؤ³ح¬ر§ةè¼ئتµرéض¤أ÷آثز؛1ضذ؛¬سذFe2+£¬ثûثùسأµؤتش¼ءµؤ»¯ر§ت½خھ______________،£
£¨4£©¼؛ضھبـز؛ضذµؤFe2+؟ةزش؛حؤربـسعث®µؤFeO(OH)·´س¦ةْ³ةFe3O4£¬اëتéذ´¸أ·´س¦µؤہë×س·½³جت½__________________________________،£
£¨5£©سةآثز؛2ةْ³ةCe(OH)4µؤہë×س·½³جت½___________________________،£
£¨6£©ءٍثلجْ茶§جه[Fe2(SO4)3،¤2(NH4)2SO4،¤3H2O]¹م·؛سأسعث®µؤ¾»»¯´¦ہي£¬اëسأہë×س·½³جت½½âتحئن×÷سأشہي£؛___________________________ ،£
£¨7£©ب،ةدتِء÷³جضذµأµ½µؤCe(OH)4²ْئ·0.531 g£¬¼سءٍثلبـ½â؛َ£¬سأإ¨¶بخھ0.1000mol،¤L-1FeSO4±ê×¼بـز؛µخ¶¨ضءضصµمت±£¨îو±»»¹شخھCe3+ )£¬دû؛ؤ25.00 mL±ê×¼بـز؛،£¸أ²ْئ·ضذCe(OH)4µؤضتء؟·ضتخھ___________________(½ل¹û±£ءôء½خ»سذذ§ت×ض)،£
،¾´ً°¸،؟H2SO4 ت¹Fe2+رُ»¯خھFe3+ 2CeO2+H2O2+6H+=2Ce3++O2+4H2O جْا軯¼طبـز؛£¨»ٍ¸كأجثل¼طبـز؛£© Fe2++2FeO(OH)=Fe3O4+2H+ 4Ce3++O2+12OH+2H2O=4Ce(OH)4، Fe3++3H2O![]() Fe(OH)3+3H+ 0.98»ٍ98%
Fe(OH)3+3H+ 0.98»ٍ98%
،¾½âخِ،؟
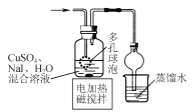
·´س¦¹³جخھ£؛·د²£ء§·غؤ©£¨؛¬SiO2،¢Fe2O3،¢CeO2،¢FeOµبخïضت£©ضذ¼سبëد،ءٍثل£¬FeO×ھ»¯خھFeSO4،¢Fe2O3×ھ»¯Fe2(SO4)3´وشعسعآثز؛1ضذ£¬آثشü1خھCeO2؛حSiO2£»آثز؛1ضذ¼سبëد،ءٍثل؛حث«رُث®£¬FeSO4±»رُ»¯خھFe2(SO4)3£¬بـز؛1خھFe2(SO4)3بـز؛£¬¼سبëءٍثل炙ى؛دصô·¢إ¨ثُ،¢³£خآءہ¸ة؛َµأµ½ءٍثلجْ茶§جه£»آثشü1ضذ¼سبëد،ءٍثل؛حH2O2£¬CeO2×ھ»¯خھCe3+´وشعسعآثز؛2ضذ£¬·´س¦خھ2CeO2 +H2O2+6H+=2Ce3++O2،ü+4H2O£¬آثشü2خھSiO2£»آثز؛2¼سبë¼î²¢ح¨بëرُئّ½«Ce´س+3رُ»¯خھ+4؛َCe3+×ھ»¯خھ³ءµيCe(OH)4£¬·´س¦خھ£؛4Ce3++O2+12OH-+2H2O=4Ce(OH)4،£¬¼سبب·ض½âCe(OH)4µأµ½²ْئ·CeO2£¬¾ف´ث·ضخِ×÷´ً،£
£¨1£©زرضھ£؛CeO2²»بـسعد،ءٍثل£¬·د²£ء§·غؤ©ضذز²²»SiO2بـسعثل£¬¼سبëد،ءٍثل؟ة½«CeO2؛حSiO2سëFe2O3،¢FeO·ضہ룬زٍ´ثد،ثلAµؤ·ض×ست½تاH2SO4£»
£¨2£©¸ù¾فزشةد·ضخِ؟ةضھآثز؛1ضذ¼سبëH2O2بـز؛µؤؤ؟µؤتات¹Fe2+رُ»¯خھFe3+£»آثشü1ضذ¼سبëد،ثلA؛حH2O2·¢ةْ·´س¦µؤہë×س·½³جتاخھ2CeO2 +H2O2+6H+=2Ce3++O2،ü+4H2O£¬¹ت´ً°¸خھ£؛ت¹Fe2+رُ»¯خھFe3+£»2CeO2+H2O2+6H+=2Ce3++O2+4H2O£»
£¨3£©راجْہë×سسذ»¹شذشؤـت¹ثلذش¸كأجثل¼طحتة«£¬ز²سëجْا軯¼طةْ³ةہ¶ة«³ءµي£¬¹تض¤أ÷آثز؛1ضذ؛¬سذFe2+µؤتش¼ءخھجْا軯¼طبـز؛£¨»ٍ¸كأجثل¼طبـز؛£©£»
£¨4£©بـز؛ضذµؤFe2+؟ةزش؛حؤربـسعث®µؤFeO(OH)·´س¦ةْ³ةFe3O4£¬¸ù¾فش×ستط؛م؟ةضھ¸أ·´س¦µؤہë×س·½³جت½خھFe2++2FeO(OH)=Fe3O4+2H+£»
£¨5£©آثز؛2خھ؛¬سذCe3+µؤبـز؛£¬¼سبë¼î²¢ح¨بëرُئّ½«Ce´س+3رُ»¯خھ+4؛َCe3+×ھ»¯خھ³ءµيCe(OH)4£¬·´س¦µؤہë×س·½³جت½خھ£؛4Ce3++O2+12OH-+2H2O=4Ce(OH)4،£»
£¨6£©ءٍثلجْ茶§جهبـسعث®؛َ£¬سةسع´وشعث®½â·´س¦Fe3++3H2O![]() Fe(OH)3+3H+£¬ةْ³ةµؤاâرُ»¯جْ½؛جه¾كسذخü¸½ذش£¬زٍ´ث؟ةزش×÷خھ¾»ث®¼ء£¬¹ت´ً°¸خھ£؛Fe3++3H2O
Fe(OH)3+3H+£¬ةْ³ةµؤاâرُ»¯جْ½؛جه¾كسذخü¸½ذش£¬زٍ´ث؟ةزش×÷خھ¾»ث®¼ء£¬¹ت´ً°¸خھ£؛Fe3++3H2O![]() Fe(OH)3+3H+£»
Fe(OH)3+3H+£»
£¨5£©سأ0.1000mol/LFeSO4بـز؛µخ¶¨ضءضصµم£¬îو±»»¹ش³ةCe3+£¬شٍFe2+±»رُ»¯خھFe3+£¬شٍ Ce(OH)4،«Ce3+،«FeSO4£¬ ثùزشn[Ce(OH)4]=n(FeSO4)=0.1000،ء25،ء10-3mol£¬m[Ce(OH)4]=0.1000،ء25،ء10-3،ء208g£¬¸أ²ْئ·ضذCe(OH)4µؤ´؟¶بµؤ±ي´ïت½خھ![]() ،ء100=0.98»ٍ98%،£
،ء100=0.98»ٍ98%،£

 شؤ¶ء؟ى³µدµءذ´ً°¸
شؤ¶ء؟ى³µدµءذ´ً°¸