题目内容
6.下列气体不能用排水集气法收集的是( )| A. | NH3 | B. | NO | C. | O2 | D. | H2 |
分析 能和水反应或极易溶于水的气体不能采用排水法收集,如果常温下和氧气不反应,可以采用排空气法收集,据此分析解答.
解答 解:A.氨气极易溶于水,常温下1体积水能溶解700体积氨气,所以氨气不能采用排水法收集,其密度小于空气,常温下和氧气不反应,可以采用向下排空气法收集,故A正确;
B.NO和水不反应也不易溶于水,可以采用排水法收集,NO和氧气反应,不能采用排空气法收集,故B错误;
C.氧气不易溶于水,且密度大于空气,可以采用排水法或向上排空气法收集,故C错误;
D.氢气不易溶于水且密度小于空气,常温下和氧气不反应,所以可以采用排水法或向下排空气法收集,故D错误;
故选A.
点评 本题考查气体的收集方法,根据气体的溶解性、密度来确定收集方法,知道常见气体的收集方法,题目难度不大.

练习册系列答案
相关题目
16.关于化学键的下列叙述中不正确的是( )
| A. | 离子化合物中可能含有共价键 | B. | 共价化合物中不可能含有离子键 | ||
| C. | 离子化合物中只含离子键 | D. | 共价化合物中不含离子键 |
17.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.已知:p(Ba2+)=-lgc(Ba2+),p(SO42-)=-lgc(SO42-).下列说法正确的是( )


| A. | 该温度下,Ksp (BaSO4 )=1.0×10-24 | |
| B. | a点的Ksp (BaSO4 )小于b点的Ksp (BaSO4 ) | |
| C. | d点表示的是该温度下BaSO4的不饱和溶液 | |
| D. | 加入BaCl2可以使溶液由 c点变到a点 |
14.第三周期元素X的原子要实现最外层8电子稳定结构,所需的电子数小于次外层和最内层的电子数之差,且等于最内层电子数的整数倍.下列说法正确的是( )
| A. | X元素最高价氧化物对应的水化物一定是强酸 | |
| B. | X元素氢化物的化学式一定为H2X | |
| C. | X的单质一定是良好的半导体材料 | |
| D. | X元素的氧化物一定能与烧碱反应 |
11.将一定量的锌与100mL 18.5mol/L浓硫酸充分反应后,锌完全溶解,同时生成气体A为33.6L(标准状况).将反应后的溶液稀释至1L,测得溶液的c(H+)=0.1mol•L-1,则下列叙述中错误的是( )
| A. | 气体A为SO2和H2的混合物 | B. | 气体A中SO2和H2的体积比为4:1 | ||
| C. | 反应中共消耗Zn 97.5g | D. | 反应中共转移3mol电子 |
18.下列关于元素周期表的叙述中不正确的是( )
| A. | 第IIA族中无非金属元素 | B. | 第IA族金属元素单质均能与水反应 | ||
| C. | 元素种类最多的族是第VIII族 | D. | 金属元素的种类比非金属元素多 |
15.已知热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(g);△H=-1256kJ•mol-1,下列正确的是( )
| A. | 乙炔的燃烧热为1256 kJ•mol-1 | |
| B. | 若生成2 mol液态水,则△H=-2512 kJ•mol-1 | |
| C. | 若形成4 mol碳氧共用电子对,则放出的热量为2512 kJ | |
| D. | 若转移10 mol电子,则消耗2.5 mol O2 |
16.白藜芦醇的结构简式为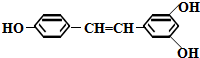 ,仅改变羟基(-OH)在苯环上的位置,且每个苯环上均含有羟基,可得到白藜芦醇的同分异构体甲,则甲可能的结构有( )
,仅改变羟基(-OH)在苯环上的位置,且每个苯环上均含有羟基,可得到白藜芦醇的同分异构体甲,则甲可能的结构有( )
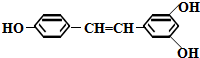 ,仅改变羟基(-OH)在苯环上的位置,且每个苯环上均含有羟基,可得到白藜芦醇的同分异构体甲,则甲可能的结构有( )
,仅改变羟基(-OH)在苯环上的位置,且每个苯环上均含有羟基,可得到白藜芦醇的同分异构体甲,则甲可能的结构有( )| A. | 13种 | B. | 15种 | C. | 17种 | D. | 19种 |