题目内容
11.将一定量的锌与100mL 18.5mol/L浓硫酸充分反应后,锌完全溶解,同时生成气体A为33.6L(标准状况).将反应后的溶液稀释至1L,测得溶液的c(H+)=0.1mol•L-1,则下列叙述中错误的是( )| A. | 气体A为SO2和H2的混合物 | B. | 气体A中SO2和H2的体积比为4:1 | ||
| C. | 反应中共消耗Zn 97.5g | D. | 反应中共转移3mol电子 |
分析 Zn和浓硫酸发生:Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O,随着反应的进行,溶液浓度减小,
稀硫酸与Zn发生:Zn+H2SO4(稀)=ZnSO4+H2↑,则生成的气体为SO2和的H2混合物,根据反应的有关方程式结合质量守恒定律列方程组计算.
解答 解:生成气体的物质的量为$\frac{33.6L}{22.4L/mol}$=1.5mol,溶液剩余硫酸的物质的量为$\frac{1}{2}$×1L×0.1mol/L=0.05mol,
参加反应的n(H2SO4)=0.1L×18.5mol/L-0.05mol=1.8mol,随着反应的进行,硫酸的浓度逐渐减小,
设反应生成xmolSO2,ymolH2,
Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O
x 2x x
Zn+H2SO4(稀)=ZnSO4+H2↑
y y y
x+y=1.5
2x+y=1.8
解之得 x=0.3,y=1.2
所以反应会生成0.3mol的二氧化硫和1.2mol的氢气.
A.由以上分析可知气体A为SO2和H2的混合物,故A正确;
B.气体A为SO2和H2的混合物,且V(SO2):V(H2)=1:4,故B错误;
C.反应中共消耗金属Zn的质量m(Zn)=(0.3mol+1.2mol)×65g/mol=97.5g,故C正确;
D.在反应Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O中,生成0.3mol的二氧化硫转移电子为0.6mol,反应Zn+H2SO4(稀)=ZnSO4+H2↑中,生成1.2mol氢气转移电子2.4mol,所以反应中共转移3mol电子,故D正确.
故选B.
点评 本题考查氧化还原反应的相关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度不大,注意浓硫酸和稀硫酸性质的不同,从质量守恒的角度解答该题,计算生成气体的物质的量关系是解答该题的关键.

 阅读快车系列答案
阅读快车系列答案| A. | 水溶液能导电 | B. | 易溶于水 | C. | 熔化时能导电 | D. | 有较高的熔点 |
| A. | 3种 | B. | 6种 | C. | 9种 | D. | 12种 |
| A. | NH3 | B. | NO | C. | O2 | D. | H2 |
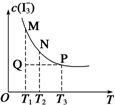 将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq).该平衡体系中,I3-的物质的量浓度与温度(T)的关系如图所示(曲 线上的任何一点都代表平衡状态).下列说法正确的是( )
将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq).该平衡体系中,I3-的物质的量浓度与温度(T)的关系如图所示(曲 线上的任何一点都代表平衡状态).下列说法正确的是( )| A. | 反应速率:vM>vP | B. | 平衡常数:KN<KP | ||
| C. | M、N两点相比,M点的c(I-)大 | D. | Q点时,v正>v逆 |
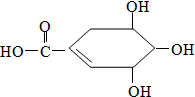 防治禽流感病毒是目前人类面临的一个重大课题.八角茴香属于草本植物,是我国民间常用做烹调的香料.医学研究成果显示,从八角茴香中可提取到莽草酸,莽草酸有抗炎、镇痛作用,也是合成对禽流感病毒有一定抑制作用的一种药物“达菲”的前体.莽草酸的结构式如图所示,下列关于莽草酸的说法正确的是( )
防治禽流感病毒是目前人类面临的一个重大课题.八角茴香属于草本植物,是我国民间常用做烹调的香料.医学研究成果显示,从八角茴香中可提取到莽草酸,莽草酸有抗炎、镇痛作用,也是合成对禽流感病毒有一定抑制作用的一种药物“达菲”的前体.莽草酸的结构式如图所示,下列关于莽草酸的说法正确的是( )| A. | 莽草酸的分子之间不能发生酯化反应 | |
| B. | 莽草酸的分子式为C7H10O5 | |
| C. | 莽草酸中含有苯环 | |
| D. | 莽草酸不能使溴水褪色 |
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | 无 |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | 无 |
| Ⅳ | 1mL | 20 |
(2)对比实验Ⅰ和Ⅳ,可以研究硫酸的浓度或氢离子浓度对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是确保溶液总体积不变.

