题目内容
14.第三周期元素X的原子要实现最外层8电子稳定结构,所需的电子数小于次外层和最内层的电子数之差,且等于最内层电子数的整数倍.下列说法正确的是( )| A. | X元素最高价氧化物对应的水化物一定是强酸 | |
| B. | X元素氢化物的化学式一定为H2X | |
| C. | X的单质一定是良好的半导体材料 | |
| D. | X元素的氧化物一定能与烧碱反应 |
分析 第三周期元素X,有3个电子层,次外层和最内层的电子数之差为8-2=6,它的原子核外最外层实现8电子稳定结构所需的电子数小于6,且等于最内层电子数的整数倍,则X元素原子核外最外层实现8电子稳定结构所需的电子数为2或4,若为2,则X为硫元素,若为4,则X为硅元素,结合元素化合物性质分析解答.
解答 解:第三周期元素X,有3个电子层,次外层和最内层的电子数之差为8-2=6,它的原子核外最外层实现8电子稳定结构所需的电子数小于6,且等于最内层电子数的整数倍,则X元素原子核外最外层实现8电子稳定结构所需的电子数为2或4,若为2,则X为硫元素,若为4,则X为硅元素,
A.若X是Si元素,其最高价氧化物对应的水化物为硅酸,硅酸是弱酸,故A错误;
B.若X是Si元素,则X元素氢化物的化学式一定为SiH4,故B错误;
C.若果X是S元素,其单质不是良好的半导体材料,故C错误;
D.二氧化硅和二氧化硫或三氧化硫都是酸性氧化物,能和氢氧化钠反应生成盐,故D正确;
故选D.
点评 本题考查了元素位置与结构的关系,正确推断元素是解本题关键,再结合元素化合物的性质分析解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列说法中,正确的是( )
| A. | IA和VIIA族元素间可形成共价化合物 | |
| B. | 第二周期:从左到右最高价从+1到+7 | |
| C. | 同主族的单核阴离子:还原性越强,离子半径越小 | |
| D. | 同周期金属:原子失电子能力越强,最高化合价越高 |
5.A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.
(1)写出A、B、C三种元素名称:氮、硫、氟.
(2)B位于周期表中第三周期第ⅥA族.
(3)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式:2NH3+H2SO4=(NH4)2SO4.
| A | C | |
| B |
(2)B位于周期表中第三周期第ⅥA族.
(3)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式:2NH3+H2SO4=(NH4)2SO4.
2.已知自然界氧的核素有16O、8O,氢的核素有 H、D,从水分子的原子组成来看,自然界的水一共有( )
| A. | 3种 | B. | 6种 | C. | 9种 | D. | 12种 |
9.X、Y、Z均为短周期元素,它们在周期表中的相对位置为:
已知X、Y、Z三种元素原子的质子数之和为31.
(1)这三种元素的元素符号:XC,YMg,ZAl.
(2)写出Y的单质在X的氧化物中燃烧的化学反应方程式:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(3)写出Z的氧化物分别与强酸溶液和强碱溶液反应的离子方程式:Al2O3+6H+=2Al3++3H2O、Al2O3+2OH-=AlO2-+2H2O.
| X | ||
| Y | Z |
(1)这三种元素的元素符号:XC,YMg,ZAl.
(2)写出Y的单质在X的氧化物中燃烧的化学反应方程式:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(3)写出Z的氧化物分别与强酸溶液和强碱溶液反应的离子方程式:Al2O3+6H+=2Al3++3H2O、Al2O3+2OH-=AlO2-+2H2O.
6.下列气体不能用排水集气法收集的是( )
| A. | NH3 | B. | NO | C. | O2 | D. | H2 |
3.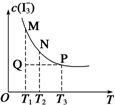 将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq).该平衡体系中,I3-的物质的量浓度与温度(T)的关系如图所示(曲 线上的任何一点都代表平衡状态).下列说法正确的是( )
将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq).该平衡体系中,I3-的物质的量浓度与温度(T)的关系如图所示(曲 线上的任何一点都代表平衡状态).下列说法正确的是( )
 将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq).该平衡体系中,I3-的物质的量浓度与温度(T)的关系如图所示(曲 线上的任何一点都代表平衡状态).下列说法正确的是( )
将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq).该平衡体系中,I3-的物质的量浓度与温度(T)的关系如图所示(曲 线上的任何一点都代表平衡状态).下列说法正确的是( )| A. | 反应速率:vM>vP | B. | 平衡常数:KN<KP | ||
| C. | M、N两点相比,M点的c(I-)大 | D. | Q点时,v正>v逆 |
4.说明金属甲比金属乙活动性强的是( )
| A. | 在氧化还原反应中,甲失电子比乙失电子多 | |
| B. | 甲在化合物中的化合价比乙在化合物中的高 | |
| C. | 甲能与稀盐酸反应生成氢气,而乙不能 | |
| D. | 甲与乙组成原电池时,甲为正极 |
