题目内容
18.下列关于元素周期表的叙述中不正确的是( )| A. | 第IIA族中无非金属元素 | B. | 第IA族金属元素单质均能与水反应 | ||
| C. | 元素种类最多的族是第VIII族 | D. | 金属元素的种类比非金属元素多 |
分析 A.第IIA族为碱土金属元素;
B.第IA族金属元素单质,具有强还原性;
C.第IIIB族含锕系、镧系元素;
D.在已经发现的一百余种元素中,金属元素的种类远比非金属元素的种类多.
解答 解:A.因第IIA族为碱土金属,均为金属,无非金属元素,故A正确;
B.第IA族元素中金属单质能与水反应生成氢气,故B正确;
C.第IIIB族含锕系、镧系元素,元素的种类最多,故C错误;
D.一百余种元素中,非金属元素有22种,则金属元素的种类远比非金属元素的种类多,故D正确;
故选C.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素位置、性质的关系为解答的关键,注意锕系元素、镧系元素的位置,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.下列物质中含有共价键的离子化合物的是( )
| A. | NaI | B. | CaCl2 | C. | CO2 | D. | KOH |
9.X、Y、Z均为短周期元素,它们在周期表中的相对位置为:
已知X、Y、Z三种元素原子的质子数之和为31.
(1)这三种元素的元素符号:XC,YMg,ZAl.
(2)写出Y的单质在X的氧化物中燃烧的化学反应方程式:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(3)写出Z的氧化物分别与强酸溶液和强碱溶液反应的离子方程式:Al2O3+6H+=2Al3++3H2O、Al2O3+2OH-=AlO2-+2H2O.
| X | ||
| Y | Z |
(1)这三种元素的元素符号:XC,YMg,ZAl.
(2)写出Y的单质在X的氧化物中燃烧的化学反应方程式:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(3)写出Z的氧化物分别与强酸溶液和强碱溶液反应的离子方程式:Al2O3+6H+=2Al3++3H2O、Al2O3+2OH-=AlO2-+2H2O.
6.下列气体不能用排水集气法收集的是( )
| A. | NH3 | B. | NO | C. | O2 | D. | H2 |
3.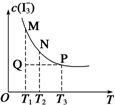 将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq).该平衡体系中,I3-的物质的量浓度与温度(T)的关系如图所示(曲 线上的任何一点都代表平衡状态).下列说法正确的是( )
将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq).该平衡体系中,I3-的物质的量浓度与温度(T)的关系如图所示(曲 线上的任何一点都代表平衡状态).下列说法正确的是( )
 将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq).该平衡体系中,I3-的物质的量浓度与温度(T)的关系如图所示(曲 线上的任何一点都代表平衡状态).下列说法正确的是( )
将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq).该平衡体系中,I3-的物质的量浓度与温度(T)的关系如图所示(曲 线上的任何一点都代表平衡状态).下列说法正确的是( )| A. | 反应速率:vM>vP | B. | 平衡常数:KN<KP | ||
| C. | M、N两点相比,M点的c(I-)大 | D. | Q点时,v正>v逆 |
10.下列物质中不含化学键的是( )
| A. | 水 | B. | 食盐 | C. | 氯气 | D. | 氦气 |