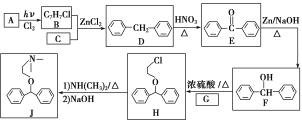
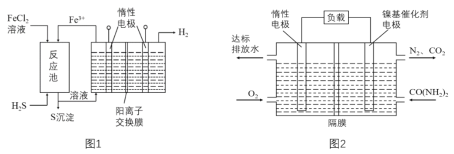
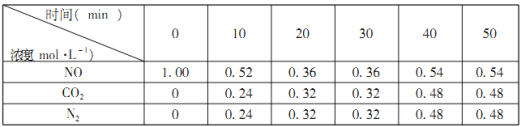
题目内容
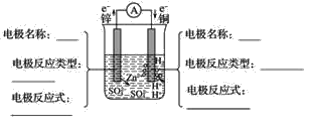
【题目】如图所示,装置在常温下工作(溶液体积变化忽略不计)。闭合K,灯泡发光。下列叙述中不正确的是( )
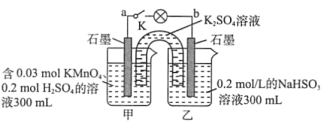
A.电池工作时,甲烧杯发生的反应为MnO4-被还原生成MnO2
B.电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a
C.乙中电极反应为HSO3--2e-+H2O=SO42-+3H+
D.当电路中有1.204×1022个电子转移时,乙烧杯中溶液的H+浓度约为0.1mol/L
【答案】A
【解析】
闭合K时,形成原电池,反应中,高锰酸钾被还原,在酸性条件下生成二价锰离子,甲烧杯中的电极为原电池的正极,乙中亚硫酸钠被氧化,因而作为原电池的负极,被氧化后生成硫酸根离子,据此解答该题。
A. 电池工作时,甲烧杯发生的反应为MnO4-被还原生成Mn2+,A项错误;
B. 盐桥中的钾离子移向正极,电子由负极向正极移动,B项正确;
C. 乙烧杯中,HSO3-离子被氧化,电极反应为HSO3--2e-+H2O=SO42-+3H+,C项正确;
D.n(电子)=![]() mol=0.02mol,根据HSO3--2e-+H2O=SO42-+3H+可知生成n(H+)=0.03mol,c(H+)=
mol=0.02mol,根据HSO3--2e-+H2O=SO42-+3H+可知生成n(H+)=0.03mol,c(H+)=![]() =0.1mol/L,D项正确;
=0.1mol/L,D项正确;
答案选A。

练习册系列答案
相关题目