题目内容
【题目】二甲氧基甲烷[CH2(OCH3)2]水溶性好、含氧量高、燃烧完全、烟气排放量低,被认为是一种极具应用前景的柴油添加剂。工业生产CH2(OCH3)2一般是在催化剂作用下,将37%的甲醛(HCHO)水溶液和甲醇(CH3OH)混合共热,反应原理如下:HCHO+2CH3OH![]() CH2(OCH3)2+H2O
CH2(OCH3)2+H2O
(1)某次研究反应时间对产率的影响的实验中,CH2(OCH3)2的浓度随反应时间变化如表:
时间(min) | 20 | 25 | 30 | 40 | 50 | 60 |
CH2(OCH3)2 (mol/L) | 9.02 | 9.10 | 9.18 | 9.23 | 9.30 | 9.32 |
计算25~50min中CH2(OCH3)2的平均生成速率为___。
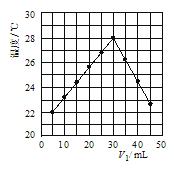
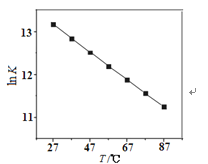
(2)研究反应的化学平衡常数(记作lnK)与温度(T)的关系如图所示,判断该反应的△H___0(填“>”、“<”、“=”)。
(3)假设在密闭容器中发生上述反应:
①达到平衡时下列措施能提高HCHO转化率的是___。
A.及时从反应体系中分离出CH2(OCH3)2
B.升高反应体系的温度
C.再添加适量甲醇
D.再添加一定量甲醛
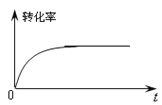
②下图是催化剂作用下甲醇转化率随时间变化的趋势曲线图。请在图中用虚线画出相同条件下,不使用催化剂时转化率随时间变化的曲线。___
(4)进一步研究发现:甲醛的滴加速率、反应时间、催化剂的量和搅拌速率等对CH2(OCH3)2的工业实际产率(不完全是平衡状态下得出的)也会产生一定影响。欲分别研究甲醛的滴加速率、搅拌速率对产率的影响,某同学设计了三组实验如表:
影响因素 实验号 | 甲醛的滴加速率(g/min) | 反应时间(min) | 催化剂的量(g) | 搅拌速率(r/min) |
1 | ___ | 70 | 2.5 | 30 |
2 | 1.0 | ___ | ___ | ___ |
3 | 2.5 | ___ | ___ | 80 |
①请在上表空格中填入剩余的实验条件数据。
②在研究过程中发现,甲醛(HCHO)的滴加速率过慢或过快均会使CH2(OCH3)2产率降低。请结合该反应的合成机理:HCHO![]() HOCH2OCH3
HOCH2OCH3![]() CH2(OCH3)2,试分析甲醛的滴加速率过快时,导致产率较低的原因可能是___。
CH2(OCH3)2,试分析甲醛的滴加速率过快时,导致产率较低的原因可能是___。
【答案】0.008mol/(L·min) < AC  1.0 70 2.5 80 70 2.5 甲醛滴加过快会使合成反应主要停留在中间产物HOCH2OCH3或实验用的是37%的甲醛溶液,不利于脱水,不利于平衡向正反应方向移动,故产率降低
1.0 70 2.5 80 70 2.5 甲醛滴加过快会使合成反应主要停留在中间产物HOCH2OCH3或实验用的是37%的甲醛溶液,不利于脱水,不利于平衡向正反应方向移动,故产率降低
【解析】
(1)由表给数据,结合速率公式计算可得;
(2)由图可知,随温度升高,平衡常数K减小,则平衡向逆反应方向移动;
(3)①依据化学平衡移动原理分析解答;
②催化剂降低反应活化能,只加快反应速率,不影响化学平衡移动;
(4)①依据探究实验时注意变量唯一化进行分析解答;
②甲醛滴加过快会使合成反应主要停留在中间产物HOCH2OCH3;实验用的是37%的甲醛溶液,不利于脱水,不利于平衡向正反应方向移动。
(1)由表格数据可知25~50min中CH2(OCH3)2的浓度的变化为(9.30-9.10)mol/L=0.20mol/L,则化学反应速率为![]()
![]() =
=![]() =0.008 mol/(L·min),故答案为:0.008mol/(L·min);
=0.008 mol/(L·min),故答案为:0.008mol/(L·min);
(2)由图可知,随温度升高,平衡常数K减小,则平衡向逆反应方向移动,正反应为放热反应,故△H<0,故答案为:<;
(3)①A、减小生成物浓度,化学平衡正反应方向移动,HCHO转化率增大,故正确;
B、该反应为放热反应,升高温度,平衡向逆反应方向移动,HCHO转化率减小,故错误;
C、增大反应物甲醇的浓度,化学平衡正反应方向移动,HCHO转化率增大,故正确;
D、再添加一定量甲醛,化学平衡正反应方向移动,HCHO转化率减小,甲醇的转化率增大,D错误;
AC正确,故答案为:AC;
②催化剂降低反应活化能,只加快反应速率,不影响化学平衡移动,故答案为: ;
;
(4)①其他条件相同时才能比较甲醛的滴加速率、搅拌速率对产率的影响,即反应时间和催化剂的量相同,反应2为比较的标准,所以反应1和反应3的甲醛滴加速率不同,反应1与反应2相同;反应1和反应3的搅拌速率不同,反应3与反应2搅拌速率相同,故答案为:1.0;70;2.5;80;70;2.5;
②甲醛滴加过快会使合成反应主要停留在中间产物HOCH2OCH3;实验用的是37%的甲醛溶液,不利于脱水,不利于平衡向正反应方向移动,故产率降低,故答案为:甲醛滴加过快会使合成反应主要停留在中间产物HOCH2OCH3或实验用的是37%的甲醛溶液,不利于脱水,不利于平衡向正反应方向移动,故产率降低。

 开心蛙状元测试卷系列答案
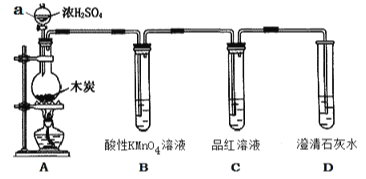
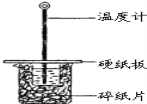
开心蛙状元测试卷系列答案【题目】实验室铝热反应的实验装置如下:
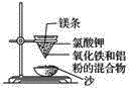
(1)下面放置盛细沙的____________(填名称)。
(2)镁条的作用是______________________________________。
(3)实验现象有:
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
(4)写出该反应的化学反应方程式:________________,在冶金工业上也常用这一反应原理来冶炼________。
A.不活泼金属 B.较活泼金属
C.稀有金属 D.高熔点金属
(5)已知下表数据:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 |
①某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量能使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?________(填“合理”或“不合理”)。
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是______________,当观察到___________________现象时,反应的离子方程式是________________________________________________________________________。
③实验室欲溶解此熔融物,最好选用下列试剂中的________(填字母)。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.NaOH溶液