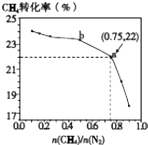
��Ŀ����
����Ŀ���������ũҩ�˰�������Ҫ�м��壮��ϳ�·�����£� 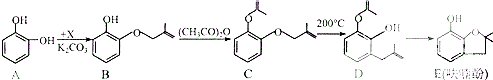
��1��A���ʺ˴Ź��������и������շ�ķ����֮��Ϊ �� B��C�ķ�Ӧ������ �� E�к��������ŵ������� �� 1molD����������molNaOH��
��2����֪X�ķ���ʽΪC4H7Cl��д��A��B�Ļ�ѧ����ʽ�� ��
��3��Y��X��ͬ���칹�壬��������֧���Ҳ���������Y������ȥ��Ӧ���ò�������ƣ�ϵͳ�������� ��
��4�������йػ�����C��D��˵����ȷ���� �� �ٿ����Ȼ�����Һ����C��D
��C��D���еĹ�������ȫ��ͬ
��C��D��Ϊͬ���칹��
��C��D����ʹ��ˮ��ɫ
��5��E�ж���ͬ���칹�壬д��������������������ͬ���칹��Ľṹ��ʽ �� �����ڷ����廯����
�ڱ����ϵ�һ�ȴ���ֻ��һ��
�ۺ�������
���ܷ���������Ӧ��
���𰸡�
��1��1��1��1��ȡ����Ӧ���ǻ����Ѽ���3
��2��
��3��1��3������ϩ
��4���٢ۢ�
��5�� ��
�� 
���������⣺��1��A����Ϊ�Գƽṹ�������к���3����ԭ�ӣ���˴Ź���������3�����շ壬����֮��Ϊ1��1��1�������Գƣ����Ա�B��C�Ľṹ��֪��B�зө�OH�ϵ�H��ȡ����B��C�ķ�Ӧ����ȡ����Ӧ����E�Ľṹ��֪�����еĹ��������ǻ����Ѽ���D���б�����̼̼˫�������ܺ��������Ʒ�����Ӧ�����з��ǻ��ܺ���������1��1��Ӧ����ѡ�ܣ����Դ��ǣ�1��1��1��ȡ����Ӧ���ǻ����Ѽ���3����2���Ա�A��B�Ľṹ����֪A��B����ȡ����Ӧ����XΪCH2=CH��CH3��CH2Cl����Ӧ����HCl���ɣ���Ӧ����ʽΪ��  �����Դ��ǣ�
�����Դ��ǣ� 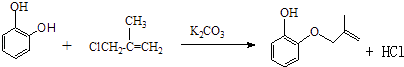 ����3��Y��X��ͬ���칹�壬��������֧���Ҳ���������YΪCH2=CHCH2CH2Cl��������ȥ��Ӧ��ȥ��ԭ�Ӽ�������̼�ϵ���ԭ���γ�̼̼˫��CH2=CHCH=CH2 �� 1��3̼�Ϻ���˫��������ϵͳ����Ϊ��1��3������ϩ�����Դ��ǣ�1��3������ϩ����4����C�������ǻ�����D���з��ǻ��������Ȼ�����Һ������ɫ��Ӧ���������Ȼ�����Һ����C��D���ʢ���ȷ����C�����Ѽ���D���з��ǻ������ߺ��й����Ų���ȫͬ���ʢڴ���C��D����ʽ��ͬ���ṹ��ͬ����Ϊͬ���칹�壬�ʢ���ȷ����C��D������̼̼˫���������巢���ӳɷ�Ӧ������ʹ��ˮ��ɫ���ʢ���ȷ�����Դ��ǣ��٢ۢܣ���5��E�ķ�����ͬ���칹�����㣺�����������ܷ���������Ӧ�����м����γɵ��������һ��ϵ�һ�ȴ���ֻ��һ�֣����E�Ľṹ��֪��Ӧ������4��������Ϊ�Գƽṹ������������ͬ���칹��Ϊ��
����3��Y��X��ͬ���칹�壬��������֧���Ҳ���������YΪCH2=CHCH2CH2Cl��������ȥ��Ӧ��ȥ��ԭ�Ӽ�������̼�ϵ���ԭ���γ�̼̼˫��CH2=CHCH=CH2 �� 1��3̼�Ϻ���˫��������ϵͳ����Ϊ��1��3������ϩ�����Դ��ǣ�1��3������ϩ����4����C�������ǻ�����D���з��ǻ��������Ȼ�����Һ������ɫ��Ӧ���������Ȼ�����Һ����C��D���ʢ���ȷ����C�����Ѽ���D���з��ǻ������ߺ��й����Ų���ȫͬ���ʢڴ���C��D����ʽ��ͬ���ṹ��ͬ����Ϊͬ���칹�壬�ʢ���ȷ����C��D������̼̼˫���������巢���ӳɷ�Ӧ������ʹ��ˮ��ɫ���ʢ���ȷ�����Դ��ǣ��٢ۢܣ���5��E�ķ�����ͬ���칹�����㣺�����������ܷ���������Ӧ�����м����γɵ��������һ��ϵ�һ�ȴ���ֻ��һ�֣����E�Ľṹ��֪��Ӧ������4��������Ϊ�Գƽṹ������������ͬ���칹��Ϊ�� 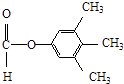 ��
�� 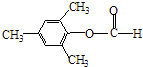 �����Դ��ǣ�
�����Դ��ǣ�  ��
��  ��
��

����Ŀ��������Ҫ��MgO��SiO2��ɣ���������Fe2O3��FeO��Al2O3�����ʣ�����������������þ�Ĺ���������ͼ��ʾ�� 
��֪ijЩ�������������pH���±���ʾ��
�������� | ��ʼ����ʱ��pH | ��ȫ����ʱ��pH |
Mg��OH��2 | 9.3 | 10.8 |
Fe��OH��2 | 7.6 | 9.6 |
Fe��OH��3 | 2.7 | 3.7 |
��1��MgO�ĵ���ʽΪ ��
��2������2����Ҫ�ɷ��� �� ������2�м������������NaOH��Һ��������Ӧ�����ӷ���ʽΪ ��
��3������NaOH������ҺpH=12.0ʱ��������Ӧ�����ӷ���ʽΪ ��
��4������Mg��OH��2�뺬SO2��������Ӧ����MgSO4 �� ����ʹ�������÷�Ӧ�Ļ�ѧ����ʽΪ ��
��5����ȡa������Ϊԭ�ϣ����õ�b��Mg��OH����Ʒ����������������þԪ������ʧ������������MgO����������Ϊ���ú���a��b�Ĵ���ʽ��ʾ����