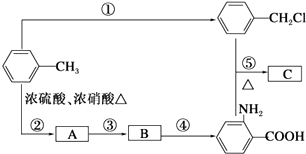
题目内容
【题目】有A、B、C、D四种元素,其中A和B原子都有1个未成对电子,A+比B﹣少一个电子层.B原子得一个电子填入3p轨道后,3p轨道已充满.C原子的p轨道中有3个未成对电子,其气态氢化物的水溶液的pH在同族氢化物中最大.D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D 40%,且其核内质子数等于中子数.据此判断:
(1)A是 , B是 , C是 , D是 . (填元素符号)
(2)B﹣的电子排布式 , A+的结构示意图 .
(3)在A、B、D三种元素的简单离子中,半径最小的是 , 其离子还原性最强的是 . (填离子符号)
【答案】
(1)Na;Cl;N;S
(2)1s22s22p63s23p6;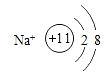
(3)Na+;S2﹣
【解析】解:B原子得一个电子填入3p轨道后,3p轨道已充满,B为Cl元素;A+比B﹣少一个电子层,则A为Na;C原子的p轨道中有3个未成对电子,C原子的外围电子排布为ns2np3 , 是第ⅤA族元素,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大,所以为N元素;D的最高化合价和最低化合价的代数和为4,为第ⅥA族元素,最高价氧化物中含D的质量分数为40%,可推知D的相对原子质量为32,其核内质子数等于中子数,所以质子数为16,D为S元素;A+是Na+离子,D2﹣离子是S2﹣离子,(1)A是 Na,B是Cl,C是N,D是S,所以答案是:Na;Cl;N;S;(2)Cl﹣的电子排布式1s22s22p63s23p6 , 钠离子的结构示意图为: 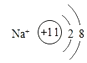 ,所以答案是:1s22s22p63s23p6;
,所以答案是:1s22s22p63s23p6; 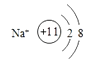 ;(3)在Na、Cl、S三种元素的简单离子中,电子层数越小半径越小,所以半径最小的是Na+ , 其离子还原性最强的是S2﹣ , 所以答案是:Na+;S2﹣ .
;(3)在Na、Cl、S三种元素的简单离子中,电子层数越小半径越小,所以半径最小的是Na+ , 其离子还原性最强的是S2﹣ , 所以答案是:Na+;S2﹣ .