题目内容
【题目】某兴趣小组利用下图装置测定某硫酸工厂排放尾气中二氧化硫的含量,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积的碘水,并通过实验测定SO2的含量。当洗气瓶C中溶液蓝色刚好消失时,立即关闭活塞A。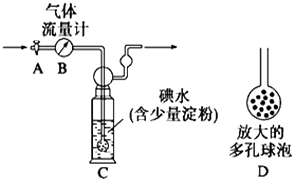
(1)C中导管末端连接一个多孔球泡D,其作用是 , 可以提高实验的准确度。
(2)C中发生反应为SO2 + I2 +2H2O = H2SO4+ 2HI , I2 是(氧化剂、还原剂)。
(3)某同学根据反应:SO2 +2FeCl3+2H2O = H2SO4+2FeCl2+2HCl,设计了一个实验,比较SO2与Fe2+ 还原性的强弱:取少量C中溶液于试管中,滴加2mL氯化铁溶液,摇匀,滴入几滴KSCN溶液,溶液不变红色 ,(试剂任选,请完善步骤、现象和结论)。
(4)① 当流量计B中刚好通过2L尾气时,C中溶液蓝色刚好消失,立即关闭活塞A,容器C中恰好得到100mL溶液,将该溶液全部转移至锥形瓶中,滴入过量BaCl2溶液,过滤、洗涤、干燥,得到4.66g 白色沉淀,通过计算可知,上述尾气中二氧化硫的含量为g/L。 (相对原子质量: Ba-137 S-32 O-16)
② 若洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量(填“偏高”、“偏低”或“无影响”).
【答案】
(1)有利于SO2与碘水反应(或被碘水充分吸收
(2)氧化剂
(3)再滴加几滴BaCl2溶液,产生白色沉淀,说明还原性SO2>Fe2+
(4)0.64,偏低。
【解析】解:(1)增大接触面积,有利于SO2与碘水的反应;
(2)I2中I的化合价由0价→-1价,化合价降低,被还原,作氧化剂;
(3)同时还要检验SO42-的存在,因此步骤是:再滴加几滴BaCl2溶液,产生白色沉淀,说明还原性 SO2>Fe2+;
(4)①根据硫元素守恒,n(SO2)=n(BaSO4)=4.66/233mol=0.02mol,其质量为0.02×64g=1.28g,含量为1.28/2g·L-1=0.64g·L-1;
②没有及时关闭活塞,通入尾气的体积增加,则测的含量偏低。

【题目】镁及其化合物用途非常广泛,目前世界上60%的镁是从海水中提取.从海水中先将海水淡化获得淡水和浓海水,浓海水的主要成分如下:
离子 | Na+ | Mg2+ | Cl﹣ | SO42﹣ |
浓度/(gL﹣1) | 63.7 | 28.8 | 144.6 | 46.4 |
再利用浓海水提镁的一段工艺流程如下图: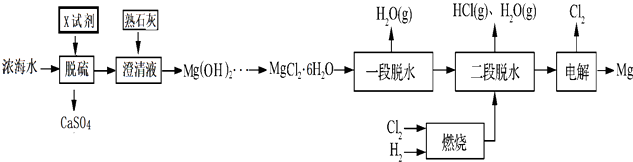
请回答下列问题
(1)浓海水主要含有的四种离子中物质的量浓度最小的是 . 在上述流程中,可以循环使用的物质是 .
(2)在该工艺过程中,X试剂的化学式为 .
(3)“一段脱水”目的是制备MgCl22H2O;“二段脱水”的目的是制备电解原料.若将MgCl26H2O直接加热脱水,则会生成Mg(OH)Cl.若电解原料中含有Mg(OH)Cl,电解时Mg(OH)Cl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率.生成MgO的化学方程式为 .
(4)若制得Mg(OH)2的过程中浓海水的利用率为80%,由Mg(OH)2至“二段脱水”制得电解原料的过程中镁元素的利用率为90%,则1m3浓海水可得“二段脱水”后的电解原料质量为g.
(5)以LiCl﹣KCl共熔盐为电解质的Mg﹣V2O5电池是战术导弹的常用电源,该电池的总反应为:Mg+V2O5+2LiCl MgCl2+V2O4Li2O 该电池的正极反应式为 .
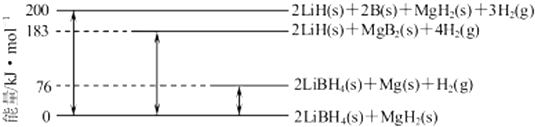
(6)Mg合金是重要的储氢材料.2LiBH4/MgH2体系放氢焓变示意图如下,则: Mg(s)+2B(s) MgB2(s)△H= .