题目内容
【题目】已知:3CH4(g)+2N2(g)3C(s)+4NH3(g)△H>0,700℃时,CH4与N2在不同物质的量之比[ ![]() ]时CH4的平衡转化率如图所示.下列说法正确的是( )
]时CH4的平衡转化率如图所示.下列说法正确的是( ) 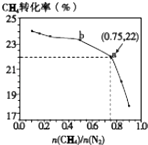
A.![]() 越大,CH4的转化率越高
越大,CH4的转化率越高
B.![]() 不变时,若升温,NH3的体积分数会增大
不变时,若升温,NH3的体积分数会增大
C.b点对应的平衡常数比a点的大
D.a点对应的NH3的体积分数约为26%
【答案】B
【解析】解:A.由图象看出,CH4的转化率随着 ![]() 的增大而降低,故A错误;
的增大而降低,故A错误;
B.△H>0,该反应是吸热反应,升高温度平衡正向移动,NH3的体积分数会增大,故B正确;
C.ab两点的温度相同,平衡常数只与温度有关,则平衡常数不变,故C错误;
D.a点甲烷转化率为22%, ![]() =0.75,则设甲烷为3mol,氮气为4mol,
=0.75,则设甲烷为3mol,氮气为4mol,
3CH4(g)+ | 2N2(g) |
| 3C(s)+ | 4NH3(g) | △H>0 | |
开始 | 3 | 4 | 0 | |||
转化 | 0.66 | 0.44 | 0.88 | |||
平衡 | 2.34 | 3.56 | 0.88 |
则NH3的体积分数约为 ![]() ×100%=13%,故D错误;
×100%=13%,故D错误;
故选B.

练习册系列答案
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目


