题目内容
4.下列说法错误的是( )| A. | 有机物CH2=CH-CH3中碳的杂化类型有sp3 和sp2,其中有两个π键,7个σ键 | |
| B. | 分子CO和N2的原子总数相同,价电子总数相等 | |
| C. | Na+的电子排布式为1s22s22p6 | |
| D. | CO2分子的构型为直线型 |
分析 A.单键为σ键,双键中有1个σ键,1个π键,甲基中的C为sp3杂化,双键上C为sp2杂化;.
B.CO和N2为等电子体;
C.钠的原子序数为11,钠离子核外有10个电子;
D.CO2分子中中心原子碳是sp杂化.
解答 解:A.单键为σ键,双键中有1个σ键,1个π键,甲基中的C为sp3杂化,双键上C为sp2杂化,则有机物CH2=CH-CH3中其碳原子杂化类型有sp3 和sp2,其中有1个π键,8个σ键,故A错误;
B.CO和N2为等电子体,则原子总数相同,价电子总数相等,故性质相似,故B正确;
C.钠的原子序数为11,钠离子核外有10个电子,离子核外电子排布为1s22s22p6,故C正确;
D.CO2分子中中心原子碳是sp杂化,所以CO2分子的构型为直线型,故D正确;
故选A.
点评 本题考查较全面,涉及电子排布、共价键的形成、等电子体、分子的空间构型等,侧重分子结构与性质的考查,题目难度不大.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
2. 如图的装置,左为铁电极,右为石墨电极,a为水或某种溶液.若两电极直接连接或外接电源,石墨上可能发生的反应是( )
如图的装置,左为铁电极,右为石墨电极,a为水或某种溶液.若两电极直接连接或外接电源,石墨上可能发生的反应是( )
①2H++2e→H2↑ ②O2+4e+2H2O→4OH- ③2Cl--2e→Cl2↑
 如图的装置,左为铁电极,右为石墨电极,a为水或某种溶液.若两电极直接连接或外接电源,石墨上可能发生的反应是( )
如图的装置,左为铁电极,右为石墨电极,a为水或某种溶液.若两电极直接连接或外接电源,石墨上可能发生的反应是( )①2H++2e→H2↑ ②O2+4e+2H2O→4OH- ③2Cl--2e→Cl2↑
| A. | ① | B. | ② | C. | ①② | D. | ①②③ |
15.下列几种物质不能长期暴露在空气中的是( )
| A. | 水晶 | B. | 水玻璃 | C. | 盐酸 | D. | 石英 |
12.NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | CO和 N2为等电子体,22.4L的CO气体和1mol N2所含的电子数相等 | |
| B. | 1L密度为1.84g•cm-3质量分数为98%的硫酸溶液中,所含氢原子数为36.8NA | |
| C. | 在标准状况下,32g氧气和臭氧的混合气体中含氧原子数为2NA | |
| D. | 在标准状况下,30g福尔马林和22.4L三氧化硫所含氧原子数之比为1:3 |
19.有关核外电子运动规律的描述错误的是( )
| A. | 核外电子质量很小,在原子核外作高速运动 | |
| B. | 核外电子的运动规律与普通物体不同 | |
| C. | 在电子云示意图中,通常用小黑点来表示电子 | |
| D. | 在电子云示意图中,小黑点密表示电子在核外空间单位体积内电子出现的机会多 |
13.m mol乙炔跟n mol氢气在密闭容器中反应,当其达到平衡时,生成p mol乙烯,将平衡混合气体完全燃烧生成CO2和H2O,所需氧气的物质的量是( )
| A. | (3m+n)mol | B. | ($\frac{5}{2}m+\frac{n}{2}•3p$)mol | C. | (3m+n+2p)mol | D. | ($\frac{5}{2}m+\frac{n}{2}$)mol |
14.糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质.以下叙述正确的是( )
| A. | 牛油、纤维素和蛋白质都是天然高分子化合物 | |
| B. | 淀粉可以使碘化钾试纸变蓝 | |
| C. | 葡萄糖能发生氧化反应和水解反应 | |
| D. | 浓硝酸溅在皮肤上,使皮肤呈黄色是由于浓硝酸和蛋白质发生了颜色反应 |
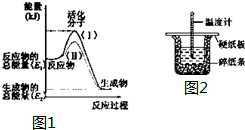 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察如图1,然后回答问题.
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察如图1,然后回答问题.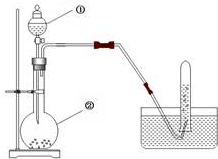 实验室用电石制取乙炔的装置如下图所示,请填空:
实验室用电石制取乙炔的装置如下图所示,请填空: