题目内容
9.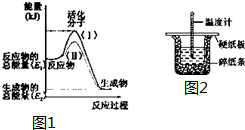 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察如图1,然后回答问题.
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察如图1,然后回答问题.(1)图中所示反应是放热(填“吸热”或“放热”)反应.
(2)已知拆开1mol H-H键、1mol I-I、1mol H-I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由1mol氢气和1mol 碘反应生成HI会放出(填“放出”或“吸收”)11kJ的热量.在化学反应过程中,是将化学能转化为热能.
(3)50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中的热量可计算中和热.回答下列问题:
①从实验装置上看,图2中尚缺少的一种玻璃用品是环形玻璃搅拌棒.
②烧杯间填满碎纸条的作用是减少实验过程中的热量损失.
③大烧杯上如不盖硬纸板,求得的中和热数值偏小(填“偏大”、“偏小”或“无影响”).
④实验中改用60mL 0.50mol•L-1盐酸跟50 mL 0.55mol•L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等”或“不相等”),所求中和热相等(填“相等”或“不相等”),简述理由:中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关.
⑤用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会偏小(均填“偏大”、“偏小”或“无影响”)
分析 (1)依据图象分析反应物的能量大于生成物的能量,反应放热;反应的焓变=生成物的能量-反应物的能量;
(2)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;
(3)①根据量热计的构造来判断该装置的缺少仪器;
②中和热测定实验成败的关键是保温工作;
③不盖硬纸板,会有一部分热量散失;
④反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
⑤根据弱电解质电离吸热分析.
解答 解:(1)由图象可知反应物的能量大于生成物的能量,反应放热,故答案为:放热;
(2)在反应H2+I2?2HI中,断裂1molH-H键,1molI-I键共吸收的能量为:1×436kJ+151kJ=587kJ,生成2molHI,共形成2molH-I键,放出的能量为:2×299kJ=598kJ,吸收的能量少,放出的能量多,所以该反应为放热反应,放出的热量为:598kJ-587kJ=11kJ,化学能转化为热能,故答案为:放出;11;化学能;热能;
(3)①根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,故答案为:环形玻璃搅拌棒;
②中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,故答案为:减少实验过程中的热量损失;
③大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,故答案为:偏小;
④反应放出的热量和所用酸以及碱的量的多少有关,用60mL 0.50mol•L-1盐酸跟50 mL 0.55mol•L-1 NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用60mL 0.50mol•L-1盐酸跟50 mL 0.55mol•L-1 NaOH溶液进行上述实验,测得中和热数值相等,
故答案为:不相等;相等;中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关;
⑤一水合氨为弱碱,电离过程为吸热过程,所以用氨水代替NaOH溶液反应,反应放出的热量小于中和热数值,故答案为:偏小.
点评 本题考查焓变的求算,△H=生成物能量-反应物能量=反应物键能和-生成物键能和,以及有关中和热的测定知识,可以根据所学知识进行回答,难度不大.

| A. | 除去(NH4)2CO3溶液中含有的少量NH4HCO3杂质的方法是加入NaOH溶液 | |
| B. | 将混有HCl的Cl2通入饱和NaHCO3溶液中不能得到纯净的氯气 | |
| C. | 向两份Fe2O3的固体中分别加入HCl溶液与HI溶液,二者反应现象相同 | |
| D. | 向固体中加入足量的浓HNO3加热,能得到使澄清石灰水变浑浊的气体,证明该固体中一定存在CO32-或HCO3- |
| A. | 有机物CH2=CH-CH3中碳的杂化类型有sp3 和sp2,其中有两个π键,7个σ键 | |
| B. | 分子CO和N2的原子总数相同,价电子总数相等 | |
| C. | Na+的电子排布式为1s22s22p6 | |
| D. | CO2分子的构型为直线型 |
| A. | 石油气、煤油和石蜡的主要成分都是碳氢化合物 | |
| B. | 含碳的化合物不一定都是有机物 | |
| C. | 由CH2=CH-COOCH3合成的聚合物为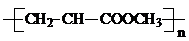 | |
| D. | 苯不具有典型双键所应具有的加成反应,故不可能发生加成反应 |
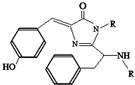 美籍华裔科学家钱永键、日本科学家下修村和美国科学家马丁•沙尔菲因在发现和研究绿色荧光蛋白(GFP)方面做出突出贡献而分享了2008年诺贝尔化学奖.经研究发现GFP中的生色基团结构如图所示,下列有关GFP的说法中正确的( )
美籍华裔科学家钱永键、日本科学家下修村和美国科学家马丁•沙尔菲因在发现和研究绿色荧光蛋白(GFP)方面做出突出贡献而分享了2008年诺贝尔化学奖.经研究发现GFP中的生色基团结构如图所示,下列有关GFP的说法中正确的( )| A. | 该有机物属于芳香烃 | |
| B. | 该有机物能发生水解反应,且1mol该有机物需消耗氢氧化钠2mol | |
| C. | 该有机物能与溴水发生取代反应消耗Br2 3mol | |
| D. | 该有机物既能与盐酸反应,又能与碳酸氢钠溶液反应 |
| A. | 在溴乙烷中直接加入AgNO3溶液 | |
| B. | 在溴乙烷中加蒸馏水,然后加入AgNO3溶液 | |
| C. | 在溴乙烷中加入NaOH溶液,加热后酸化,然后加入AgNO3溶液 | |
| D. | 在溴乙烷中加入乙醇加热后,然后加入AgNO3溶液 |


 ;D的核磁共振氢谱共有3组峰.
;D的核磁共振氢谱共有3组峰.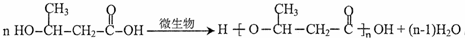 .
.
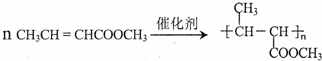 .
.