题目内容
【题目】 Ⅰ.按己知的原子结构规律,82号元素X应是第_________周期_________族元素,它的最高正价氧化物的化学式为_________。
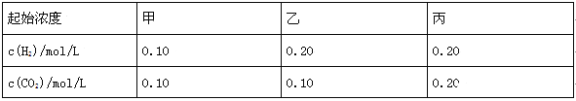
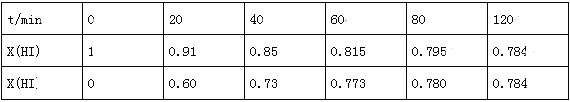
Ⅱ.下列变化中:①干冰气化;②硝酸钾熔化;③KHSO4熔融;④硫酸溶于水;⑤蔗糖溶于水;⑥HI分解。用序号填空:
(1)未破坏化学键的是_____________。
(2)仅离子键被破坏的是_____________。
(3)仅共价键被破坏的是_____________。
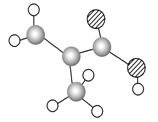
Ⅲ.有下列各组物质:①石墨和足球烯C60;②126C和136C;③CH3—CH2—CH2—CH3和CH3—CH(CH3)CH3;④漂白粉和漂白液主要成分;⑤正丁烷和异庚烷;⑥乙烯和聚乙烯;⑦![]() 和
和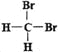 ;⑧丙烷和环丙烷。用序号填空:
;⑧丙烷和环丙烷。用序号填空:
(1)__________组两者互为同位素。(2)__________组两者互为同素异形体。
(3)__________组两者属于同系物。(4)__________组两者互为同分异构体。
(5)__________组两者是同一物质。
【答案】Ⅰ. 6 ⅣA XO2或 PbO2
Ⅱ.(1)①⑤ (2)②③ (3)④⑥
Ⅲ.(1)② (2)① (3)⑤ (4)③ (5)⑦
【解析】试题分析:Ⅰ.根据元素周期表中每周期容纳的元素种数,82-2-8-8-18-18=28,所以该元素属于第六周期,在第六周期中最右侧的元素是0族的Rn,原子序数是86,则86-82=4,即该元素所在的族和0族之间还有3列,该元素属于第ⅣA。主族元素的最高正价是族序数,所以该元素的最高价是+4价,最高价氧化物的化学式为XO2或PbO2。
Ⅱ.(1)①干冰气化、⑤蔗糖溶于水均是物理变化,未破坏化学键;
(2)②硝酸钾熔化、③KHSO4熔融均只电离出阴阳离子,且都是离子化合物,破坏的是离子键;
(3)④硫酸溶于水电离出硫酸根离子和氢离子,⑥HI分解生成氢气和碘,仅共价键被破坏。
Ⅲ.①石墨和足球烯C60是同一元素形成的不同性质的单质,互称为同素异形体;②126C和136C是同一元素的质子数相同而中子数不同的原子,互称为同位素;③CH3-CH2-CH2-CH3和 CH3-CH(CH3)CH3分子式相同,结构不同,两者是同分异构体;④漂白粉的主要成分的Ca(ClO)2,漂白液主要成分是NaClO,两者不是同种物质;⑤正丁烷和异庚烷都是烷烃,结构相似,在分子组成上若干个CH2原子团的化合物,是同系物;⑥乙烯的结构简式为CH2=CH2,聚乙烯的结构简式为![]() ,聚乙烯是混合物;⑦二溴甲烷没有同分异构体,这两个结构式表示的是二溴甲烷,属于同一物质。则
,聚乙烯是混合物;⑦二溴甲烷没有同分异构体,这两个结构式表示的是二溴甲烷,属于同一物质。则
(1)②组两者互为同位素;(2)①组两者互为同素异形体;(3)⑤组两者属于同系物;(4)③组两者互为同分异构体;(5)⑦组两者是同一物质。