题目内容
【题目】现有①0.2mol/LNaOH溶液和②0.2mol/L HX溶液,两溶液等体积混合后,测得溶液中c(Na+)>c(X—)。则:
(1)①中由水电离出的c(OH)-___②中由水电离出的c(H+)。(填“>”、“=”或“<”)
(2)上述混合液中共存在___种粒子。且:c(HX)___c(X-)。(填“>”、“=”或“<”,下同)c(HX)+c(X-)___0.1mol/L(忽略体积变化)
请根据电荷守恒写出一个用离子浓度表示的等式:___。
(3)上述混合液显___性(填“酸”、“碱”或“中”),其原因用离子方程式表示___。
(4)已知t℃,KW=1×10-13,则t℃(填“>”或“<”或“=”)___25℃。在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b=___。
【答案】< 6 < = c(Na+)+c(H+)=c(X-)+c(OH-) 碱 X-+H2O![]() HX+OH- > 9:2
HX+OH- > 9:2
【解析】
首先如果HX为强酸则会完全电离,和钠离子的浓度相同,然而不同,说明HX为弱酸,(1)、(2)、(3)靠电荷守恒,物料守恒可以解答。
(4)、水的电离是吸热反应,升高温度促进水电离,其离子积常数增大;该温度下pH=11的NaOH浓度为0.01mol/L、pH=1的硫酸溶液中氢离子浓度为0.1mol/L,二者混合后pH=2,则混合溶液中氢离子浓度为0.01mol/L,据此解答。
(1)、氢氧化钠为强碱电离的氢氧根多,抑制水电离氢氧根程度大,HX为弱酸,电离的氢离子较少,对水电离氢离子的抑制小,①中由水电离出的c(OH-)②中由水电离出的c(H+),故答案为:>;
(2)、溶液中有H2O、OH-、H+、HX、X-、Na+六种离子,不论是弱酸的电离还是水解,程度都是比较小的,所以:c(HX)<c(X-),根据物料守恒:c(HX)+c(X-)应该是等于0.1mol/L的,电荷守恒有c(Na+)+c(H+)=c(X-)+c(OH-),故答案为:6 ;< ;= ;c(Na+)+c(H+)=c(X-)+c(OH-);
(3)、溶液相当于NaX的液体,HX为弱酸,则有X-+H2O![]() HX+OH-,溶液显碱性,故答案为:碱;X-+H2O
HX+OH-,溶液显碱性,故答案为:碱;X-+H2O![]() HX+OH-;
HX+OH-;
(4)、水的电离是吸热反应,升高温度促进水电离,其离子积常数增大,Kw= 1×10-13> 1×10-14,则t℃> 25℃,该温度下pH=11的NaOH浓度为0.01mol/L、pH=1 的硫酸溶液中氢离子浓度为0.1mol/L,二者混合后pH=2,则混合溶液中氢离子浓度为0.01mol/L=![]() ,a: b=9:2,故答案为:> ;9:2.。
,a: b=9:2,故答案为:> ;9:2.。

【题目】由下列实验及现象推出的相应结论正确的是 ( )
选项 | 实验 | 现象 | 结论 |
A | 某溶液中滴加K3 [Fe(CN)6]溶液 | 产生蓝色沉淀 | 原溶液中有Fe2+,Fe3+ |
B | 向C6H5ONa溶液中通入CO2 | 溶液变浑浊 | 酸性:H2CO3>C6H5OH |
C | 向K2Cr2O7的酸性溶液中滴加乙醇 | 橙色溶液变为绿色 | 乙醇发生消去反应生成乙烯 |
D |
|
| 原溶液中有SO42- |
A.AB.BC.CD.D
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
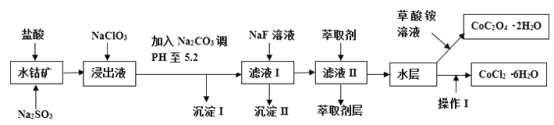
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等;②沉淀I中只含有两种沉淀;③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中Co2O3发生反应的离子反应方程式为_________________。
(2)NaClO3在浸出液中发生的离子反应方程式为______________。
(3)加入Na2CO3调PH至5.2,目的是________;萃取剂层含锰元素,则沉淀II的主要成分为_____。
(4)操作I包括:将水层加入浓盐酸调整PH为2-3,______、_____、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是_____(回答一条原因即可)。
【题目】某研究性学习组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:(已知H2C2O4是弱酸)
实验 序号 | 实验 温度 | KMnO4溶液 | H2C2O4溶液 | H2O | 溶液褪色时间 | ||
V(mL) | c(mol/L) | V(mL) | c(mol/L) | V(mL) | t(s) | ||
A | 293K | 2 | 0.05 | 8 | 0.25 | 0 | t1 |
B | T1 | 2 | 0.05 | 6 | 0.25 | V1 | 8 |
C | 313K | 2 | 0.05 | 6 | 0.25 | 2 | t2 |
(1)通过实验A、B,可探究出___的改变对反应速率的影响,其中
(2)通过实验____可探究出温度变化对化学反应速率的影响。
(3)若t1<8,则由实验A、B可以得出的结论是____;利用实验B中数据计算,从反应开始到有结束,用KMnO4的浓度变化表示的反应速率为______。
(4)该反应中有无色无味气体产生,且锰被还原为Mn2+,写出相应反应的离子方程式 ________。
(5)该小组的一位同学通过查阅资料发现:反应一段时间后该反应速率会加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是 ____。