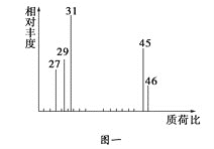
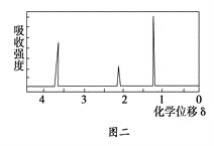
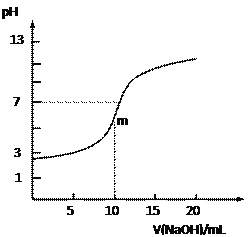
题目内容
【题目】由下列实验及现象推出的相应结论正确的是 ( )
选项 | 实验 | 现象 | 结论 |
A | 某溶液中滴加K3 [Fe(CN)6]溶液 | 产生蓝色沉淀 | 原溶液中有Fe2+,Fe3+ |
B | 向C6H5ONa溶液中通入CO2 | 溶液变浑浊 | 酸性:H2CO3>C6H5OH |
C | 向K2Cr2O7的酸性溶液中滴加乙醇 | 橙色溶液变为绿色 | 乙醇发生消去反应生成乙烯 |
D |
|
| 原溶液中有SO42- |
A.AB.BC.CD.D
【答案】B
【解析】
A. K3 [Fe(CN)6]与Fe2+反应生成蓝色沉淀,由现象可知原溶液中有Fe2+,但不能确定是否含Fe3+,A错误;
B. C6H5ONa溶液中通入CO2,生成苯酚,发生较强酸制较弱酸的反应,则酸性:H2CO3>C6H5OH,B正确;
C.向K2Cr2O7的酸性溶液中滴加乙醇,橙色溶液变为绿色,乙醇发生氧化反应生成乙酸,C错误;
D. SO32-与Ba(NO3)2溶液反应生成BaSO3沉淀,加入盐酸后,BaSO3被氧化为BaSO4沉淀,则不能确定原溶液中是否含有SO42-,D错误。
答案选B。

 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案【题目】下列实验操作、现象和结论都正确的是 ( )
选项 | 实验操作 | 现象 | 结论 |
A | 将石蜡油分解产生的气体通入酸性高锰酸钾溶液中 | 紫红色溶液变无色 | 石蜡油裂解一定产生了乙烯 |
B | 用水浸过的棉花包裹铁粉放入试管并加热,将气体通入四氯化碳溶液中 | 四氯化碳中产生气泡 | 铁粉与水蒸气在高温下一定产生了氢气 |
C | 向重铬酸钾溶液中滴加乙醇 | 橙红色溶液变绿色 | 乙醇表现出还原性 |
D | 向2ml0.1mol/L的AgNO3溶液中先滴加2滴0.1mol/L NaCl溶液,再滴入 | 先产生白色沉淀,后沉淀变成黄色 | 相同温度下,AgCl在水中的溶解度大于AgI的溶解度 |
A.AB.BC.CD.D
【题目】某校学生用中和滴定法测定某NaOH溶液的物质的量浓度,选甲基橙作指示剂。
(1)配制250mL 0.2000 mol/L盐酸标准溶液,所需玻璃仪器有______、______量筒、烧杯、玻璃棒。
(2)盛装0.2000 mol/L盐酸标准液应该用______式滴定管。(填“酸”或“碱”)
(3)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视_________,直到加入一滴盐酸后,溶液由_________,即到终点。
(4)滴定操作可分解为如下几步:
①检查滴定管是否漏水;
②取一定体积的待测液于锥形瓶中;
③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管;
④装标准溶液和待测液并调整液面(记录初始读数);
⑤用蒸馏水洗涤玻璃仪器;⑥滴定操作
正确的操作顺序为:_________。
(5)有关数据记录如下:
实验序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.60 | 20.70 |
2 | 20.00 | 6.00 | 25.90 |
3 | 20.00 | 1.40 | 23.20 |
则NaOH溶液的物质的量浓度为__________mol/L。
(6)若滴定时锥形瓶未干燥,则测定结果____________;若滴定前平视读数,滴定终点时仰视读数,则所测碱的浓度值_________。(填“无影响”、“偏高”或“偏低”)。