题目内容
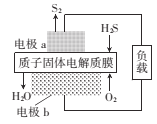
【题目】(1)氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。其正极反应方程式为________________________,若将负极材料改为CH4,写出其负极反应方程式_________________________。
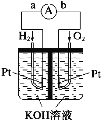
(2)以NH3代替氢气研发燃料电池是当前科研的一个热点。使用的电解质溶液是2molL﹣1的KOH溶液,电池总反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为____________________;每消耗3.4g NH3转移的电子数目为_________。
(3)图为青铜器在潮湿环境中因发生电化学反应而被腐蚀的原理示意图。

①腐蚀过程中,负极是_______(填图中字母“a”或“b”或“c”);
②环境中的Cl- 扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为______________;
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为_______L(标况)。
【答案】O2+2H2O+4e-=4OH- CH4+10OH--8e-=CO32-+7H2O 2NH3+6OH--6e-=N2+6H2O 0.6NA c 2Cu2++3OH-+ Cl-=Cu2 (OH)3Cl↓ 0.448L
【解析】
(1)装置图分析为原电池反应,通氢气的电极为负极,氢气失电子发生氧化,反应在碱性溶液中生成水,通入氧气的电极为原电池正极,氧气得到电子发生还原反应生成氢氧根离子,若将负极材料改为CH4,负极为燃料甲烷失电子发生氧化反应,写出方程式;
(2)电池反应为: 4NH3+3O2=2N2+6H2O,该电池负极是氨气失电子生成氮气,写出方程式;根据消耗NH3的物质的量,计算转移的电子数;
(3) ①根据原电池相关原理,进行分析;
②Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2 (OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2 (OH)3Cl沉淀;
③计算生成Cu2 (OH)3Cl沉淀的物质的量,再转化为氧气,进行相应计算。
(1)装置图分析为原电池反应,通氢气的电极为负极,氢气失电子发生氧化,反应在碱性溶液中生成水,通入氧气的电极为原电池正极,氧气得到电子发生还原反应生成氢氧根离子,正极电极反应为:O2+2H2O+4e-=4OH-;若将负极材料改为CH4,负极为燃料甲烷失电子发生氧化反应,负极的电极反应方程式为: CH4+10OH--8e-=CO32-+7H2O,故答案为:O2+2H2O+4e-=4OH-;CH4+10OH--8e-=CO32-+7H2O;
(2)电池反应为: 4NH3+3O2=2N2+6H2O,该电池负极是氨气失电子生成氮气,反应的电极反应式为2NH3+6OH--6e-=N2+6H2O;反应中2mol氨气反应电子转移6mol电子,每消耗3.4gNH3物质的量=![]() , 转移的电子数为0.6NA,故答案为:2NH3+6OH--6e-=N2+6H2O;0.6NA;
, 转移的电子数为0.6NA,故答案为:2NH3+6OH--6e-=N2+6H2O;0.6NA;
(3)①根据图知,氧气得电子生成氢氧根离子、Cu失电子生成铜离子,发生吸氧腐蚀,则Cu作负极,即c是负极,故答案为:c;
②Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2 (OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2 (OH)3Cl沉淀,离子方程式为2Cu2++3OH-+ Cl-=Cu2 (OH)3Cl↓,故答案为:2Cu2++3OH-+ Cl-=Cu2 (OH)3Cl↓;
③n[Cu2 (OH)3Cl] =![]() ,根据转移电子得n(O2)=
,根据转移电子得n(O2)=![]() ,V(O2)=
,V(O2)= ![]() ,故答案为:0.448L。
,故答案为:0.448L。