题目内容
【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,可用于处理部分含硫废水。某小组在实验室中利用下列装置制备ClO2(此制备方法中经空气稀释的SO2与ClO2不反应)。
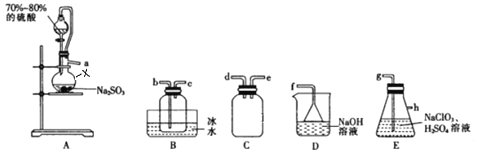
回答下列问题:
(1)仪器X的名称是__________________________。
(2)欲选择上图中的装置收集ClO2,其连接顺序为a→______(按气流方向,用小写字母表示)。
(3)装置C的作用是_________,装置E中反应的离子方程式为__________________________________。
(4)处理含硫(Na2S)碱性废水时,ClO2与Na2S反应(S2-被氧化为SO42-)的离子方程式为_________________;处理含硫碱性废水时,相同条件下同体积的ClO2相对于Cl2的优点是______________________________。
(5)ClO2很不稳定,需现用现配,为测定所得溶液中ClO2的含量,进行下列实验:
步骤1:准确量取V1 mL ClO2溶液加入锥形瓶中。
步骤2:用稀硫酸调节ClO2溶液的pH≤2.0,再加入足量KI晶体,静置片刻。
步骤3:加入指示剂,用c mol·L-1的Na2S2O3标准溶液滴定至终点时,消耗V2 mL Na2S2O3标准溶液。
(已知:2ClO2+8H++10I-===2C1-+5I2+4H2O;2S2O32-+I2===2I-+S4O62-)原溶液中ClO2的含量为____________(用含c、V1、V2的代数式表示)g·L-1。
【答案】蒸馏烧瓶 d-e-g-h-b-c-f 防倒吸 SO2+2ClO3-=2ClO2+SO42- 8ClO2-+5S2-+8OH-=8Cl-+5SO42-+4 H2O ClO2得电子数是Cl2的2.5倍,除硫酸率高 ![]()
【解析】
(1)根据仪器结构和性能确定仪器X的名称;
(2)ClO2 的制备:装置A中又Cu与浓硫酸发生反应制备SO2气体,在装置E中反应生成二氧化氯,为防止倒吸,A与E之间连接装置C,二氧化氯沸点较低,故在B中冰水浴收集,最后用氢氧化钠吸收未反应完的二氧化硫,防止污染空气,据此分析解答;
(3)SO2气体在装置E中反应生成二氧化氯较快,为防止倒吸,在A与E之间连接装置C,SO2和KClO3反应时,KClO3被还原生成ClO2,则SO2被氧化生成SO42-,结合电子守恒、电荷守恒写出反应的离子方程式;
(4)根据实验可知ClO2 与 Na2S 反应有氯离子、硫酸根离子的生成;根据ClO2和Cl2除硫效果分析;
(5)由2ClO2+8H++10I-═2Cl-+5I2+4H2O、2S2O32-+I2═2I-+S4O62-得到关系式为ClO2~5S2O32-,有n(ClO2)=![]() n(S2O32-)。
n(S2O32-)。
(1)仪器X的名称是蒸馏烧瓶;
(2)二氧化硫从a进入装置E中反应,为防止倒吸,应在E之前有安全瓶,则a→d→e,为反应充分,故连接E装置中的g,二氧化氯沸点较低,故在B中冰水浴收集,为充分冷却,便于收集,应连接b,最后用氢氧化钠吸收未反应完的二氧化硫,防止污染空气,连接顺序为:d→e→g→h→b→c→f ;
(3)SO2气体在装置E中反应生成二氧化氯较快,在A与E之间连接装置C为防止倒吸,SO2还原KClO3生成ClO2,则SO2被氧化生成SO42-,反应的离子方程式为
SO2+2ClO3-=2ClO2+SO42-;
(4)由上述分析可知ClO2 与 Na2S 反应有氯离子、硫酸根离子的生成,所以反应的离子方程式为:8ClO2+5S2-+4H2O=8Cl-+5SO42-+8H+;ClO2除硫效果彻底,氧化产物硫酸根更稳定、ClO2在水中的溶解度大、剩余的ClO2不会产生二次污染、相同质量的ClO2、Cl2均被还原为氯离子时,ClO2得到的电子数是氯气的2.5倍等;
(5)由2ClO2+8H++10I-═2Cl-+5I2+4H2O、2S2O32-+I2═2I-+S4O62-得到关系式为ClO2~5S2O32-,所以n(ClO2)=![]() n(S2O32-)=
n(S2O32-)=![]() ×V2×10-3×cmol=2cV2×10-4mol,m(ClO2)=nM=2cV2×10-4mol×67.5g/mol=1.35cV2×10-2g,原溶液中ClO2的含量=
×V2×10-3×cmol=2cV2×10-4mol,m(ClO2)=nM=2cV2×10-4mol×67.5g/mol=1.35cV2×10-2g,原溶液中ClO2的含量=![]() =
=![]() g/L。
g/L。