题目内容
【题目】(1)X、Y、L、M为核电荷数依次增大的前20号主族元素。X2是最轻的气体,Y、L与M三种元素的质子数均为5的倍数。回答下列问题:
①X与L组成的最简单化合物的电子式为_________。
②X与M组成的物质为________________(填“共价”或“离子”)化合物。
③L在周期表中的位置是________________。
(2)1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
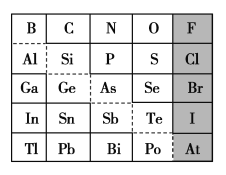
①根据元素周期律,推断:
a.H3AsO4、H2SeO4的酸性强弱:H3AsO4________(填“>”“<”或“=”)H2SeO4;
b.氢化物的稳定性:HCl________(填“>”“<”或“=”)H2S;
c.原子半径比较:N________(填“>”“<”或“=”)Si
② NaClO的电子式为____________,工业上制漂白液的原理为________________________(用离子方程式表示)
③从下列试剂中选择最佳试剂组合,比较C、Si的非金属性强弱___________________ (可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、硅酸钠溶液)
【答案】![]() 离子 第三周期第ⅤA族 < > <
离子 第三周期第ⅤA族 < > < ![]() Cl2 + 2OH- = Cl- + ClO- + H2O CaCO3固体、盐酸、饱和NaHCO3溶液、Na2SiO3溶液
Cl2 + 2OH- = Cl- + ClO- + H2O CaCO3固体、盐酸、饱和NaHCO3溶液、Na2SiO3溶液
【解析】
X、Y、L、M为核电荷数依次增大的前20号主族元素。X2是最轻的气体,则X为氢元素;Y、L与M三种元素的质子数均为5的倍数,则Y为硼元素、L为磷元素、M为钙元素。比较最高价氧化物的水化物的酸性、氢化物的稳定性时,应比较非金属性;比较原子半径时,可利用同周期、同主族元素的原子半径递变规律进行推断;比较C、Si的非金属性,可利用化学反应,比较其最高价氧化物的水化物的酸性。
(1)由以上分析可知,X、Y、L、M分别为H、B、P、Ca元素。
①X与L组成的最简单化合物为PH3,其电子式为![]() 。
。
②X与M组成的物质为CaH2,由Ca2+和H-构成,属于离子化合物。
③L的原子结构示意图为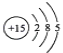 ,在周期表中的位置是第三周期第ⅤA族。答案为:
,在周期表中的位置是第三周期第ⅤA族。答案为:![]() ;离子;第三周期第ⅤA族;
;离子;第三周期第ⅤA族;
(2)①a.As与Se为同周期元素,As在Se的左边,非金属性As<Se,所以H3AsO4、H2SeO4的酸性强弱:H3AsO4<H2SeO4;
b.非金属性Cl>S,所以氢化物的稳定性:HCl>H2S;
c.依据元素在周期表中的位置,原子半径N<P<Si,所以原子半径:N<Si。
② NaClO为离子化合物,由Na+和ClO-构成,电子式为![]() ,工业上制漂白液时,将Cl2通入NaOH溶液中,反应原理为Cl2 + 2OH- = Cl- + ClO- + H2O。
,工业上制漂白液时,将Cl2通入NaOH溶液中,反应原理为Cl2 + 2OH- = Cl- + ClO- + H2O。
③比较C、Si的非金属性强弱时,可比较H2CO3与H2SiO3的酸性强弱,H2CO3可由CaCO3固体与盐酸反应制取,然后用饱和NaHCO3溶液除去CO2中混有的HCl,最后通入硅酸钠溶液中,发生反应:Na2SiO3+CO2+H2O==H2SiO3↓+Na2CO3。所以选择的药品有CaCO3固体、盐酸、饱和NaHCO3溶液、Na2SiO3溶液。
答案为:<;>;<;![]() ;Cl2 + 2OH- = Cl- + ClO- + H2O;CaCO3固体、盐酸、饱和NaHCO3溶液、Na2SiO3溶液。
;Cl2 + 2OH- = Cl- + ClO- + H2O;CaCO3固体、盐酸、饱和NaHCO3溶液、Na2SiO3溶液。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】下列对一些实验事实的理论解释正确的是( )
选项 | 实验事实 | 理论解释 |
A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
B | SO2为V形分子 | SO2分子中S原子采用sp3杂化 |
C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
A. AB. BC. CD. D