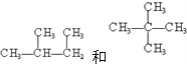
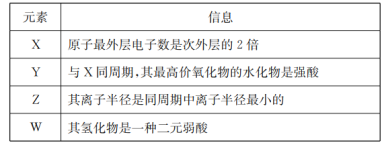
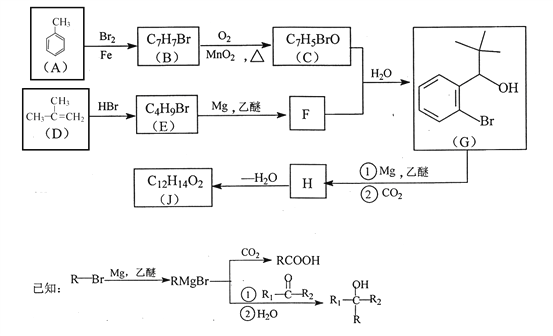
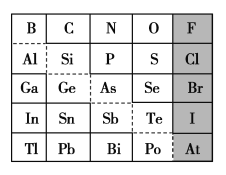
题目内容
【题目】含氯消毒剂可有效杀灭新冠病毒(2019-nCoV)。某学习小组根据需要欲制备浓度不小于0.8mol/L的次氯酸溶液。装置见下图。
资料1:常温常压下,Cl2O为棕黄色气体,沸点为3.8℃,42℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水立即反应生成HClO。
资料2:将氯气和空气(不参与反应)按体积比 1∶3混合通入含水8%的碳酸钠中制Cl2O,并用水吸收Cl2O(不含Cl2)制得次氯酸溶液。
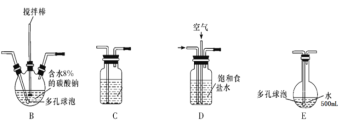

(1)电极Y应该连接电源的___(填“正极”或“负极”),装置C内应盛放_________,各装置的连接顺序为A—________________________________
(2)反应过程中,装置B需放在冷水中,其目的是_____________________________。已知装置B产物含有一种酸式盐,则发生反应的化学方程式为___________________。
(3)实验中控制氯气与空气体积比的方法是_______________________________
(4)装置E中使用棕色平底烧瓶的原因是(用化学方程式表示)________________
(5)此方法相对于用氯气直接溶于水制备次氯酸溶液的优点是(答出一条即可)_____。
(6)若装置B中生成的Cl2O气体有20%滞留在E前各装置中,其余均溶于装置E的水中,装置E所得500mL次氯酸溶液浓度为0.8mol/L,则至少需要含水8%的碳酸钠的质量为___g。
【答案】正极 足量CCl4 ADBCEF 防止反应放热后温度过高导致Cl2O分解 2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3 通过观察A中产生气泡的速率调节流速 2HClO![]() 2HCl+O2↑ 制得的次氯酸溶液浓度较大或制得的次氯酸溶液纯度较高或制得的次氯酸溶液不含有Cl-或氯元素的利用率高 57.6
2HCl+O2↑ 制得的次氯酸溶液浓度较大或制得的次氯酸溶液纯度较高或制得的次氯酸溶液不含有Cl-或氯元素的利用率高 57.6
【解析】
(1)电极Y处产生氯气,发生反应为氯离子失去电子变为氯气,据此分析;装置C的主要作用是除去Cl2O中的Cl2,根据相似相溶原理,氯气易溶于四氯化碳;欲制备浓度不小于0.8mol/L的次氯酸溶液,先制取氯气,然后除去氯气中的氯化氢,将氯气和空气(不参与反应)按体积比1:3混合通入潮湿的碳酸钠中发生反应,除去未反应的氯气,用水吸收Cl2O(不含Cl2)制得次氯酸溶液,据此分析连接装置;
(2)防止反应放热后温度过高导致Cl2O分解,装置B需放在冷水中;根据化合价的升降必然有NaCl,同时还生成了一种酸式盐只能是NaHCO3,据此书写方程式;
(3)可以根据气泡的产生速度来控制气体通入的速度;
(4)HClO见光分解;
(5)此方法相对于用氯气直接溶于水制备次氯酸溶液主要优点是制得的次氯酸溶液纯度较高,浓度较大等;
(6)装置B中生成的Cl2O气体有20%滞留在E前各装置中,根据n=cV计算装置E所得次氯酸的物质的量,根据Cl2O+H2O=2HClO、2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3进行计算。
(1)本实验是通过电解氯化铜溶液制得氯气,即Y极应作阳极,氯离子放电生成氯气。所以Y应连接正极。A装置制备氯气,D装置用饱和食盐水可以降低氯气的溶解,且形成氯气和空气(1:3)的混合气体,与含水8%的碳酸钠充分反应制备Cl2O,由于Cl2O为极性分子,Cl2为非极性分子,根据相似相溶原理,氯气易溶于四氯化碳中,所以可以装在C中吸收Cl2O中的Cl2,E装置中用水吸收Cl2O制备次氯酸溶液,F作为尾气处理装置,所以各装置的连接顺序为ADBCEF;
(2)由题可知,42℃以上Cl2O会分解生成Cl2和O2,故为防止反应放热后温度过高导致Cl2O分解,装置B需放在冷水中。Cl2和2Na2CO3反应生成Cl2O是氧化还原反应,根据化合价的升降必然有NaCl,同时还生成了一种酸式盐只能是NaHCO3,故化学方程式为2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3;
(3)将氯气和空气(不参与反应)以体积比约1:3混合通入含水8%的碳酸钠中制备Cl2O,可通过观察A中产生气泡的速率调节流速,从而控制氯气与空气体积比;
(4)装置C中使用棕色平底烧瓶可以避光,防止反应生成的HClO见光分解,方程式为:2HClO![]() 2HCl+O2↑;
2HCl+O2↑;
(5)相比于氯气直接溶解水中发生歧化反应,必然导致有一部分氯元素生成了氯离子,造成了Cl原子的损失。本实验的方法是Cl2O+H2O=2HClO,原子利用率100%;
(6)装置E所得500mL次氯酸溶液浓度为0.8mol/L,n=cV=0.5mol×0.8mol/L=0.4mol,Cl2O+H2O=2HClO,反应的二氧化氯为0.2mol,装置B中生成的Cl2O气体有20%滞留在E前各装置中,制得的二氧化氯的物质的量为![]() =0.25mol,2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3,需碳酸钠的物质的量为0.5mol,质量为0.5mol×106g/mol=53g,则至少需要含水8%的碳酸钠的质量为
=0.25mol,2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3,需碳酸钠的物质的量为0.5mol,质量为0.5mol×106g/mol=53g,则至少需要含水8%的碳酸钠的质量为![]() ≈57.6g。
≈57.6g。

【题目】I. 在一定条件下,可逆反应A+B![]() mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况。
mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况。

(1)温度T1________T2(填“大于”“等于”或“小于”)。
(2)正反应是________反应(填“吸热”或“放热”)。
(3)如果A、B、C均为气体,则m________2(填“大于”“等于”或“小于”)。
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强________(填“增大”“减小”或“不变”),平衡_________________移动(填“向正反应方向”“向逆反应方向”或“不”)。
II. CO是生产羰基化学品的基本原料, 850℃时,在恒容密闭容器中通入CO和H2O(g),发生:CO(g)+H2O(g) ![]() H2(g)+CO2(g)
H2(g)+CO2(g) ![]() H<0,测定浓度随时间关系如下表:
H<0,测定浓度随时间关系如下表:
t/min | c(CO)/ mol·L-1 | c(H2O)/ mol·L-1 |
0 | 0.30 | 0.20 |
2 | \ | 0.10 |
3 | 0.18 | \ |
4 | \ | 0.08 |
回答下列问题
(1)t=3min时,υ(正)____________υ(逆)(选填:“>”,“<”,“=”)。
(2)0~2min,CO的平均反应速率为 ____________。
(3)上述反应中的CO平衡转化率为____________。
(4)在一定条件下,发生下列反应:CO(g)+H2O(g) ![]() H2(g)+CO2(g),其逆反应的速率随时间变化曲线如图所示,则t1时改变的某种反应条件可能是_____(填序号)。
H2(g)+CO2(g),其逆反应的速率随时间变化曲线如图所示,则t1时改变的某种反应条件可能是_____(填序号)。

a.增大CO浓度
b.加压
c.恒容时充入氩气
d.使用催化剂