题目内容
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是
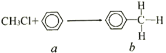
A. 0.5mol雄黄(As4S4),结构如右图,含有NA个S-S键![]()
B. 将1molNH4NO3溶于适量稀氨水中,所得溶液呈中性,则溶液中NH4+的数目为NA
C. 标准状况下,33.6L二氯甲烷中含有氯原子的数目为3NA
D. 高温下,16.8gFe与足量水蒸气完全反应,转移的电子数为0.6NA
【答案】B
【解析】A.S原子最外层有六个电子,形成2个共价键,As原子最外层五个,形成3个共价键,由结构图知白色球为硫原子,分子中不存在S-S键,故A错误;B.NH4NO3==NH4++ NO3-,NH3.H2O![]() NH4++OH-,溶于适量稀氨水中,所得溶液呈中性,则溶液中n(NH4+)=n(NO3-), NH4+的数目等于NA,故B正确;C.标况下,二氯甲烷为液体,不能使用气体摩尔体积,故C错误;D.16.8g铁的物质的量为0.3mol,而铁与水蒸汽反应后变为+8/3价,故0.3mol铁失去0.8mol电子即0,8NA个,所以D错误;所以B选项是正确的。
NH4++OH-,溶于适量稀氨水中,所得溶液呈中性,则溶液中n(NH4+)=n(NO3-), NH4+的数目等于NA,故B正确;C.标况下,二氯甲烷为液体,不能使用气体摩尔体积,故C错误;D.16.8g铁的物质的量为0.3mol,而铁与水蒸汽反应后变为+8/3价,故0.3mol铁失去0.8mol电子即0,8NA个,所以D错误;所以B选项是正确的。

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案【题目】I. 在一定条件下,可逆反应A+B![]() mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况。
mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况。
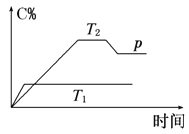
(1)温度T1________T2(填“大于”“等于”或“小于”)。
(2)正反应是________反应(填“吸热”或“放热”)。
(3)如果A、B、C均为气体,则m________2(填“大于”“等于”或“小于”)。
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强________(填“增大”“减小”或“不变”),平衡_________________移动(填“向正反应方向”“向逆反应方向”或“不”)。
II. CO是生产羰基化学品的基本原料, 850℃时,在恒容密闭容器中通入CO和H2O(g),发生:CO(g)+H2O(g) ![]() H2(g)+CO2(g)
H2(g)+CO2(g) ![]() H<0,测定浓度随时间关系如下表:
H<0,测定浓度随时间关系如下表:
t/min | c(CO)/ mol·L-1 | c(H2O)/ mol·L-1 |
0 | 0.30 | 0.20 |
2 | \ | 0.10 |
3 | 0.18 | \ |
4 | \ | 0.08 |
回答下列问题
(1)t=3min时,υ(正)____________υ(逆)(选填:“>”,“<”,“=”)。
(2)0~2min,CO的平均反应速率为 ____________。
(3)上述反应中的CO平衡转化率为____________。
(4)在一定条件下,发生下列反应:CO(g)+H2O(g) ![]() H2(g)+CO2(g),其逆反应的速率随时间变化曲线如图所示,则t1时改变的某种反应条件可能是_____(填序号)。
H2(g)+CO2(g),其逆反应的速率随时间变化曲线如图所示,则t1时改变的某种反应条件可能是_____(填序号)。

a.增大CO浓度
b.加压
c.恒容时充入氩气
d.使用催化剂