题目内容
7.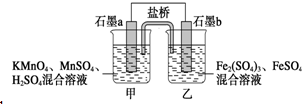 某小组将反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计为如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为2mol•L-1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液.下列说法中错误的是( )
某小组将反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计为如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为2mol•L-1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液.下列说法中错误的是( )| A. | 电池工作时,盐桥中的SO42-移向乙烧杯 | |
| B. | 石墨b的电极反应式为Fe2+-e-═Fe3+ | |
| C. | 当有0.1 mol SO42-进入烧杯时,反应消耗H+0.2 mol | |
| D. | 当 MnSO4浓度变为2.2 mol•L-1时,反应中转移电子0.2 mol(不考虑溶液的体积变化) |
分析 由2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O可知,Mn元素的化合价降低,得到电子,Fe元素的化合价升高,失去电子,则b为负极,a为正极,结合原电池中负极发生氧化反应,电流从正极流向负极,阴离子向负极移动来解答.
解答 解:A、原电池中阴离子影响负极,b为负极,所以盐桥中的SO42-移向乙烧杯,故A正确;
B、Fe元素的化合价升高,失去电子,电极反应式为Fe2+-e-═Fe3+,故B正确;
C、当有0.1 mol SO42-进入烧杯时,转移0.2mol电子,据2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O可知,每转移10mol电子有16mol氢离子消耗,所以转移0.2mol电子,消耗氢离子为3.2mol,故C错误;
D、每生成1molMnSO4转移电子5mol,MnSO4浓度变为2.2 mol•L-1时,生成MnSO40.04mol,转移电子0.2mol,故D正确;
故选C.
点评 本题综合考查原电池知识,侧重于学生的分析能力的考查,为高考常见题型和高频考点,注意把握原电池的工作原理,答题时注意体会电极方程式的书写方法,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.设阿伏伽德罗常数为NA,下列说法正确的是( )
| A. | pH=1 的H2SO4溶液中所含H+的个数为0.1NA | |
| B. | 100mL 0.1mol•L-1的NH4Cl溶液所含NH4+的个数为0.01NA | |
| C. | 电解精炼铜的过程中,外电路转移NA个电子,阴极生成铜的质量为32g | |
| D. | 将2molSO2和10molO2充入一密闭容器中完全反应后,生成SO3的分子数为2NA |
15.下列反应既利用了浓硫酸的强氧化性,又利用了浓硫酸的酸性的是( )
| A. | 碳与浓硫酸加热 | B. | 浓硫酸与NaCl固体加热 | ||
| C. | 浓硫酸中加入铜片 | D. | 蔗糖与浓硫酸混合后炭化发黑 |
2.如图各装置在正常工作时,都伴随有能量变化,其中由化学能转变为电能的是( )
| A. |  电解水 | B. |  干电池 | ||
| C. |  太阳能热水器 | D. |  水力发电 |
12.G.X.Y.Z.Q均为氯(Cl)的含氧化合物,它们有如下关系:
①G→Q+NaCl
②Q+H2O-→X+H2
③Y+NaOH→G+Q+H2O
④Z+NaOH→Q+X+H2O
这五种化合物中,氯的化合价由低到高的顺序是( )
①G→Q+NaCl
②Q+H2O-→X+H2
③Y+NaOH→G+Q+H2O
④Z+NaOH→Q+X+H2O
这五种化合物中,氯的化合价由低到高的顺序是( )
| A. | QGZYX | B. | GYQZX | C. | GYZQX | D. | ZXGYQ |
19.碳具有还原性,能与氧化铜发生反应:2CuO+C $\frac{\underline{\;高温\;}}{\;}$ 2Cu+CO2↑,该反应的基本类型为( )
| A. | 置换反应 | B. | 化合反应 | C. | 分解反应 | D. | 复分解反应 |
16.下列作用不属于水解反应的是( )
| A. | 吃馒头时多咀嚼后有甜味 | |
| B. | 淀粉溶液和稀H2SO4共热一段时间后,滴加碘水不显蓝色 | |
| C. | 把生鸡蛋煮成熟鸡蛋 | |
| D. | 油脂与NaOH溶液共煮后可以制得肥皂 |
17.下列物质中,不能用直接化合制取的是( )
| A. | Fe(OH)3 | B. | FeCl3 | C. | CuS | D. | FeCl2 |