题目内容
19.碳具有还原性,能与氧化铜发生反应:2CuO+C $\frac{\underline{\;高温\;}}{\;}$ 2Cu+CO2↑,该反应的基本类型为( )| A. | 置换反应 | B. | 化合反应 | C. | 分解反应 | D. | 复分解反应 |
分析 由题意,碳具有还原性,能与氧化铜发生反应:2CuO+C $\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑;置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,据此进行分析判断.
解答 解:碳具有还原性,能与氧化铜发生反应:2CuO+C $\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑,该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应.
故选:A.
点评 本题难度不大,掌握置换反应的特征(反应物和生成物均是两种,其中一种是单质和另一种是化合物)是正确解答本题的关键.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
10.下列各组物质中,一定互为同系物的是( )
| A. | 乙烷和己烷 | B. | CH3COOH、C3H6O2 | C. | 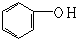 和 和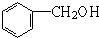 | D. | HCHO、CH3COOH |
7.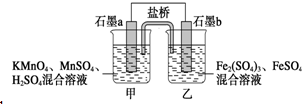 某小组将反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计为如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为2mol•L-1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液.下列说法中错误的是( )
某小组将反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计为如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为2mol•L-1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液.下列说法中错误的是( )
 某小组将反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计为如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为2mol•L-1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液.下列说法中错误的是( )
某小组将反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计为如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为2mol•L-1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液.下列说法中错误的是( )| A. | 电池工作时,盐桥中的SO42-移向乙烧杯 | |
| B. | 石墨b的电极反应式为Fe2+-e-═Fe3+ | |
| C. | 当有0.1 mol SO42-进入烧杯时,反应消耗H+0.2 mol | |
| D. | 当 MnSO4浓度变为2.2 mol•L-1时,反应中转移电子0.2 mol(不考虑溶液的体积变化) |
14.下列图标中,表示“剧毒品”的是( )
| A. |  | B. |  | C. |  | D. |  |
4.下列各组物质中化学键的类型完全相同的一组是( )
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O2 CO2 | ||
| C. | CaCl2 NaOH H2O | D. | C2H6 H2O2 C2H4 |
11.在一定条件下,反应N2+3H2?2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为( )
| A. | v(H2)=0.015mol/(L•min) | B. | v(N2)=0.02mol/(L•min) | ||
| C. | v(NH3)=0.17mol/(L•min) | D. | v(NH3)=0.02mol/(L•min) |
8.在容积不变的密闭容器中进行如下反应:H2O(g)+C(s)?H2(g)+CO(g)△H>0 达到平衡后,改变下列反应条件,相关叙述正确的是( )
| A. | 加入H2O(g),平衡向正反应方向移动,体系压强减小 | |
| B. | 加入少量C,正反应速率增大 | |
| C. | 降低温度,平衡向正反应方向移动 | |
| D. | 加入CO,混合气体的密度增大 |
9.在标准状况下,将VLA气体(摩尔质量为Mg/mol)溶于0.1L水中,所得溶液密度为dg/ml,则此溶液的物质的量浓度为( )(单位为mol/L)
| A. | $\frac{MV}{22.4(V+0.1)d}$ | B. | $\frac{1000VdM}{MV+2240}$ | C. | $\frac{1000Vd}{MV+2240}$ | D. | $\frac{Vd}{MV+2240}$ |
 ,该反应的反应类型是加成反应.
,该反应的反应类型是加成反应.