题目内容
15.下列反应既利用了浓硫酸的强氧化性,又利用了浓硫酸的酸性的是( )| A. | 碳与浓硫酸加热 | B. | 浓硫酸与NaCl固体加热 | ||
| C. | 浓硫酸中加入铜片 | D. | 蔗糖与浓硫酸混合后炭化发黑 |
分析 硫酸既能表现出酸性又表现出氧化性,在反应中应生成硫酸盐,且硫酸被还原生成二氧化硫等物质,据此解答.
解答 解:A.碳与浓硫酸加热生成二氧化碳和二氧化硫,硫元素化合价都降低,浓硫酸只表现氧化性,故A不选;
B.浓硫酸与NaCl固体加热生成氯化氢和硫酸氢钠,反应中硫元素化合价不变,表现浓硫酸的难挥发性和酸性,不表现氧化性,故B不选;
C.铜与浓硫酸反应生成硫酸铜、二氧化硫和水,硫酸既表现出了强氧化性又表现了酸性,故C选;
D.蔗糖与浓硫酸混合后炭化发黑,表现浓硫酸脱水性和强氧化性,不表现酸性,故D不选;
故选:C.
点评 本题考查了元素化合物知识,熟悉硫酸的强氧化性、酸性是解题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.下列实验操作或所记录的数据合理的是( )
| A. | NaOH溶液可保存在玻璃塞的试剂瓶中 | |
| B. | 液溴应盛放在用水密封且用玻璃塞塞紧的棕色试剂瓶中 | |
| C. | 一学生用广泛pH试纸测得某浓度的稀盐酸pH为2.3 | |
| D. | 配制硫酸亚铁溶液,是将绿矾晶体溶于蒸馏水再加入一定量的铁粉 |
6.下列表示物质结构的化学用语或模型正确的是( )
| A. | 甲烷分子的比例模型 | B. | 氨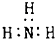 | ||
| C. | Cl-离子的结构示意图 | D. | 8个中子的碳原子的符号${\;}_{6}^{14}$C |
3.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 46g乙醇中含有的化学键数为7NA | |
| B. | 1mol氯气和足量NaOH溶液反应转移电子数为2NA | |
| C. | 1mol OH- 和1 mol-OH(羟基)中含有的质子数均为9NA | |
| D. | 10L 0.1 mol•L-1 的Na2CO3溶液中,Na+、CO32- 总数为3NA |
10.下列各组物质中,一定互为同系物的是( )
| A. | 乙烷和己烷 | B. | CH3COOH、C3H6O2 | C. | 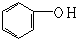 和 和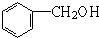 | D. | HCHO、CH3COOH |
20.用惰性电极电解下列溶液,电解一段时间后,电解质溶液的pH上升的是( )
| A. | 饱和NaCl溶液 | B. | AgNO3 | C. | CuCl2 | D. | 饱和NaOH溶液 |
7.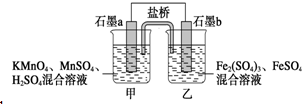 某小组将反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计为如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为2mol•L-1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液.下列说法中错误的是( )
某小组将反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计为如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为2mol•L-1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液.下列说法中错误的是( )
 某小组将反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计为如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为2mol•L-1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液.下列说法中错误的是( )
某小组将反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计为如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为2mol•L-1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液.下列说法中错误的是( )| A. | 电池工作时,盐桥中的SO42-移向乙烧杯 | |
| B. | 石墨b的电极反应式为Fe2+-e-═Fe3+ | |
| C. | 当有0.1 mol SO42-进入烧杯时,反应消耗H+0.2 mol | |
| D. | 当 MnSO4浓度变为2.2 mol•L-1时,反应中转移电子0.2 mol(不考虑溶液的体积变化) |
4.下列各组物质中化学键的类型完全相同的一组是( )
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O2 CO2 | ||
| C. | CaCl2 NaOH H2O | D. | C2H6 H2O2 C2H4 |
5.青苹果汁遇碘水显蓝色,熟苹果汁与新制Cu(OH)2反应产生砖红色沉淀,说明( )
| A. | 青苹果中只含淀粉不含糖类 | B. | 熟苹果中只含糖类不含淀粉 | ||
| C. | 苹果转熟时淀粉水解产生有葡萄糖 | D. | 苹果转熟时葡萄糖聚合成淀粉 |