题目内容
12.G.X.Y.Z.Q均为氯(Cl)的含氧化合物,它们有如下关系:①G→Q+NaCl
②Q+H2O-→X+H2
③Y+NaOH→G+Q+H2O
④Z+NaOH→Q+X+H2O
这五种化合物中,氯的化合价由低到高的顺序是( )
| A. | QGZYX | B. | GYQZX | C. | GYZQX | D. | ZXGYQ |
分析 G、Q、X、Y、Z均为氯的含氧化合物,根据氧化还原反应中Cl元素的化合价升降来分析解答.
解答 解:①G→Q十NaCl中,NaCl中Cl元素为-1价,则Cl元素的化合价为Q>G>-1,
③Y十NaOH→G十Q十H2O中,结合①可知Cl元素的化合价为Q>Y>G,
②Q+H2O→X+H2中,H元素的化合价降低,则Cl元素的化合价升高,所以Cl元素的化合价为X>Q,
④Z十NaOH→Q十X十H2O中,结合②可知,Cl元素的化合价为X>Z>Q,
所以五种化合物中氯的化合价由低到高的顺序为GYQZX,
故选B.
点评 本题考查氧化还原反应,明确氧化还原反应中元素的化合价变化是解答本题的关键,难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
2.有一种新型燃料电池,工作时在一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-.现用该燃料电池和惰性电极电解Na2SO4溶液一段时间,假设电解时温度不变,下列说法不正确的是( )
| A. | 在熔融电解质中,O2-由正极移向负极 | |
| B. | 电解一共生成0.9 mol气体时,理论上消耗0.1 mol丁烷 | |
| C. | 电解池的阳极反应式为4OH--4e-═2H2O+O2↑ | |
| D. | 通入空气的一极是正极,电极反应式为O2+4e-═2O2- |
3.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 46g乙醇中含有的化学键数为7NA | |
| B. | 1mol氯气和足量NaOH溶液反应转移电子数为2NA | |
| C. | 1mol OH- 和1 mol-OH(羟基)中含有的质子数均为9NA | |
| D. | 10L 0.1 mol•L-1 的Na2CO3溶液中,Na+、CO32- 总数为3NA |
20.用惰性电极电解下列溶液,电解一段时间后,电解质溶液的pH上升的是( )
| A. | 饱和NaCl溶液 | B. | AgNO3 | C. | CuCl2 | D. | 饱和NaOH溶液 |
7.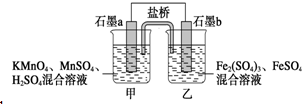 某小组将反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计为如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为2mol•L-1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液.下列说法中错误的是( )
某小组将反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计为如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为2mol•L-1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液.下列说法中错误的是( )
 某小组将反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计为如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为2mol•L-1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液.下列说法中错误的是( )
某小组将反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计为如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为2mol•L-1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液.下列说法中错误的是( )| A. | 电池工作时,盐桥中的SO42-移向乙烧杯 | |
| B. | 石墨b的电极反应式为Fe2+-e-═Fe3+ | |
| C. | 当有0.1 mol SO42-进入烧杯时,反应消耗H+0.2 mol | |
| D. | 当 MnSO4浓度变为2.2 mol•L-1时,反应中转移电子0.2 mol(不考虑溶液的体积变化) |
17.下列符号中,表示两个氢原子的是( )
| A. | H2 | B. | 2H2 | C. | $\stackrel{+1}{H}$ | D. | 2H |
4.下列各组物质中化学键的类型完全相同的一组是( )
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O2 CO2 | ||
| C. | CaCl2 NaOH H2O | D. | C2H6 H2O2 C2H4 |
1.下列反应中,改变反应物浓度或用量,不会改变反应产物的是( )
| A. | 硫化氢在氧气中燃烧 | B. | 二氧化硫通入石灰水中 | ||
| C. | 铁在硫蒸气中燃烧 | D. | 硫酸中加入铁粉 |
2.下列电离方程式错误的是( )
| A. | NH3•H2O?NH4++OH- | B. | H2SO3?2H++SO32- | ||
| C. | Fe(OH)3?Fe3++3OH- | D. | H2SO4→2H++SO42- |