题目内容
18. 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.(1)现有如下两个反应:A.NaOH+HCl=NaCl+H2O;B.Zn+H2SO4=ZnSO4+H2↑判断能否设计成原电池A.不能,B.能.(填“能”或“不能”)
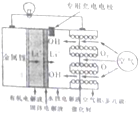
(2)将纯锌片和纯铜片按图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:①下列说法正确的是bd.
a.甲、乙均为化学能转变为电能的装置
b.乙中铜片上没有明显变化
c.甲中铜片质量减少、乙中锌片质量减少
d.两烧杯中溶液中的H+均减小
②在相同时间内,两烧杯中产生气泡的速度:甲>乙(填“>”、“<“或“=”)
③请写出图中构成原电池的负极电极反应式Zn-2e-=Zn2+.
电池工作时,溶液中SO42-向负极移动电池工作完成后,溶液中SO42-浓度不变(填增大或减小或不变)
分析 (1)自发的氧化还原反应才能设计成原电池;
(2)①甲装置符合原电池构成条件,所以是原电池,乙不能形成闭合回路,所以不能构成原电池,两个烧杯中,锌都失电子发生氧化反应,甲中铜上氢离子得电子发生还原反应,乙中锌上氢离子得电子发生还原反应;
②作原电池负极的金属加速被腐蚀;
③原电池负极的金属失电子发生氧化反应,依据原电池中阴离子流向负极及据硫酸根离子未参与电极反应判断其浓度.
解答 解:(1)反应A.NaOH+HCl=NaCl+H2O不是氧化还原反应,不能设计成原电池,反应B.Zn+H2SO4=ZnSO4+H2↑是氧化还原反应,能设计成原电池,
故答案为:不能;能;
(2)①甲装置是原电池,发生电化学腐蚀,乙装置发生化学腐蚀.
a、甲是化学能转变为电能的装置,乙不是,故a错误;
b、乙装置中铜片不反应,也没构成原电池的正极,所以铜片上没有明显变化,故b正确;
c、甲、乙中锌片质量都减少,故c错误;
d、两个烧杯中都产生氢气,氢离子浓度都降低,故d正确;
故选bd;
②原电池原理引起的腐蚀速度大于化学腐蚀的速度,故答案为:>;
③构成原电池的负极是锌失电子发生氧化反应,电极反应式为Zn-2e-=Zn2+,电池工作时,SO42-流向负极,由于硫酸根离子未参与电极反应,故反应完成后浓度不变,故答案为:Zn-2e-=Zn2+;负;不变.
点评 本题考查学生原电池的构成条件以及燃料电池的工作原理知识,属于综合知识的考查,难度不大.

练习册系列答案
相关题目
6.在元素周期表中金属与非金属的分界处,可以找到( )
| A. | 农药 | B. | 催化剂 | C. | 半导体材料 | D. | 合金 |
7.下列叙述中,金属A的活泼性肯定比金属B的活泼性强的是( )
| A. | A是原子的主族序数比B原子的主族序数大 | |
| B. | A原子的周期序数B原子的周期序数大 | |
| C. | 1mol A与酸反应置换出的H2比1mol B与酸反应置换出的H2多 | |
| D. | 把AB用导线连接后放入盛有稀硫酸的烧杯中,B上产生气泡 |
6.上海人张霞昌在芬兰发明了“纸电池”,这种一面镀锌、一面镀二氧化锰的超薄电池在使用印刷与压层技术后,变成一张可任意裁剪大小的“电纸”,纸内的离子“流过”水和氧化锌组成的电解质溶液,电池总反应式为:Zn+2MnO2+H2O═ZnO+2MnOOH.下列说法正确的是( )
| A. | 该电池的负极材料为锌 | |
| B. | 该电池反应中二氧化锰发生了氧化反应 | |
| C. | 电池的正极反应式为MnO2+H2O+e-═MnOOH+OH- | |
| D. | 当有0.1 mol锌溶解时,流经电解质溶液的电子数为1.204×1023 |
13. 如图所示是一种新型的锂空气电池,该新型锂一空气电池无需充电,只需更换正极的水性电解液,通过卡盒等方式更换负极的金属锂就可以连续使用,正极生成的氢氧化锂可以从使用过的水性电解液中回收,再提炼出金属锂,金属锂则可再次作为原料循环使用,下列有关该锂电池的叙述不正确的是( )
如图所示是一种新型的锂空气电池,该新型锂一空气电池无需充电,只需更换正极的水性电解液,通过卡盒等方式更换负极的金属锂就可以连续使用,正极生成的氢氧化锂可以从使用过的水性电解液中回收,再提炼出金属锂,金属锂则可再次作为原料循环使用,下列有关该锂电池的叙述不正确的是( )
 如图所示是一种新型的锂空气电池,该新型锂一空气电池无需充电,只需更换正极的水性电解液,通过卡盒等方式更换负极的金属锂就可以连续使用,正极生成的氢氧化锂可以从使用过的水性电解液中回收,再提炼出金属锂,金属锂则可再次作为原料循环使用,下列有关该锂电池的叙述不正确的是( )
如图所示是一种新型的锂空气电池,该新型锂一空气电池无需充电,只需更换正极的水性电解液,通过卡盒等方式更换负极的金属锂就可以连续使用,正极生成的氢氧化锂可以从使用过的水性电解液中回收,再提炼出金属锂,金属锂则可再次作为原料循环使用,下列有关该锂电池的叙述不正确的是( )| A. | 放电时,锂离子(Li+)穿过固体电解质移到负极的水性电解液中 | |
| B. | 充电时,阳极的电极反应式为:4OH--4e-=O2+2H2O | |
| C. | 熔融的氢氧化锂用惰性电极电解再生时,在阴极可得到金属锂,放电时负极的电极反应式为:Li-e-=Li+ | |
| D. | 充电时,锂极与外电源的负极相连 |
3.短周期元素X、Y、Z、W原子序数依次增大.X的质子数与电子层数相同,Y、Z同周期且相邻,Z的最外层电子数是其内层电子数的3倍,元素W在地壳中的含量仅次于氧.下列说法正确的是( )
| A. | 原子半径:r(W)>r(Y)>r(Z)>r(X) | |
| B. | X、Y、Z三种元素形成的化合物中只有共价键 | |
| C. | 最高价氧化物对应水化物的酸性:W>Y | |
| D. | 气态简单氢化物的热稳定性:Y>Z |
7.下列各物质中,按熔点由低到高排列正确的是( )
| A. | O2、I2、Hg | B. | CO2、KCl、SiO2 | ||
| C. | HF、HCl、HBr | D. | CH4、C2H5OH、C4H10 |
8.下列解释事实的方程式正确的是( )
| A. | 利用铝热反应焊接钢轨:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3 | |
| B. | 用氯水除去FeCl3溶液中的Fe2+:Cl2+Fe2+═2Cl-+Fe3+ | |
| C. | 用已知浓度的NaOH溶液测定未知浓度的醋酸溶液的浓度:H++OH-═H2O | |
| D. | 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2Na++2OH-═Na2SiO3+H2O |
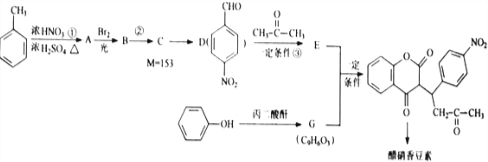
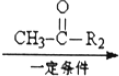 R1-CH=
R1-CH=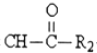 +H2O
+H2O .
. .
. .
.