题目内容
【题目】氨在工农业生产中应用广泛。在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下表:
温度/℃ | 200 | 300 | 400 | 500 | 600 |
氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
请回答:
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是_______。
(2)在一定温度下,将2molN2和6molH2通入到体积为2L的密闭容器中,发生反应N2+3H2![]() 2NH3,2min达到平衡状态时,H2转化率是50%,该温度下的平衡常数K=_______________(结果用最简分数表示);欲使K增大,可以采取的措施是______。
2NH3,2min达到平衡状态时,H2转化率是50%,该温度下的平衡常数K=_______________(结果用最简分数表示);欲使K增大,可以采取的措施是______。
(3)从化学平衡移动的角度分析,提高H2转化率可以采取的措施是______(选填序号字母)
a.及时分离出NH3 b.升高温度 c.增大压强 d.使用催化剂
(4)NH3能分解为N2和H2,在相同条件下,测得分解后混合气体密度为分解前的2/3,则氨的分解率为_____________。
【答案】 温度升高,氨在混合气体中的体积分数减小,平衡向逆反应方向移动,温度升高平衡向吸热方向移动,故正反应是放热反应 16/27 降低温度 ac 50%
【解析】(1)根据勒夏特列原理,升高温度,氨气减小,说明平衡逆向移动,从而判断正反应放热。
(2) N2 + 3H2 ![]() 2NH3
2NH3
起始: 2 6 0
反应: 1 3 2 (氢气转化率50%,所以3mol氢气反应)
平衡: 1 3 2 (除以2L容器得浓度为:0.5 1.5 1)
![]()
正反应放热,降低温度可以使K值增加。
(3)a及时分离出NH3,反应平衡向正反应方向移动,增大氢气转化率;b升高温度平衡向逆反应方向移动,转化率降低;c增大压强平衡正向移动,转化率增大;d催化剂不改变平衡,转化率不变。
(4)根据质量守恒定律,反应物质的总质量不变,所以分解后混合气体密度为分解前的2/3,说明分解后混合气体体积为分解前的1.5倍。由阿伏加德罗定律,体积是1.5倍,说明物质的量是1.5倍,设初始加入氨气Xmol:
2NH3 ![]() N2 + 3H2
N2 + 3H2
起始: X 0 0
反应: Y 0.5Y 1.5Y
平衡: X-Y 0.5Y 1.5Y
有:X-Y+0.5Y+1.5Y=1.5X,Y=0.5X,转化率为50%

【题目】中和热的测定实验中取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
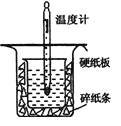
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是__________,除此之外,装置中的一个明显错误是_____________。
(2)若改用60mL 0.25mol·L-1 H2SO4和50mL 0.55mol·L-1 NaOH溶液进行反应与上述实验相比,所放出的热量_______(填“相等”或“不相等”)
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.5 |
2 | 27.0 | 27.4 | 27.2 | 32.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
4 | 26.4 | 26.2 | 26.3 | 29.8 |
(3)近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),通过以上数据计算中和热ΔH=_______( 结果保留小数点后一位)。
(4)上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中