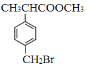
题目内容
【题目】某溶液中含有HCO3﹣、SO32﹣、Na+、CH3COO﹣等四种离子,向其中加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积不变)( )
A.CH3COO﹣B.SO32﹣C.Na+D.HCO3﹣
【答案】A
【解析】
A.醋酸根离子浓度基本不会发生变化,故A正确;
B.过氧化钠具有氧化性,将亚硫酸根离子氧化成了硫酸根离子,亚硫酸根离子浓度大量减少,故B错误;
C.过氧化钠和水反应生成了氢氧化钠,引进了大量钠离子,钠离子浓度增大,故C错误;
D.碳酸氢根离子和过氧化钠与水反应生成的氢氧根离子反应生成碳酸根离子和水,碳酸氢根离子浓度减少,故D错误;
答案:A

【题目】某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题: 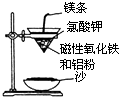
(1)铝热反应实验:取磁性氧化铁粉按课本中的实验装置(如图)进行铝热反应,将反应
后所得“铁块”溶于盐酸,向反应后的溶液中滴加KSCN溶液,发现溶液变血红色.
①出现这种现象的原因,除了因“铁块”中可能混有没反应完的磁性氧化铁外,还有一种可能原因是 .
②若要证明反应所得“铁块”中含有金属铝,可用(填化学式)溶液,所发生反应的离子方程式为 .
(2)化学反应速率影响因素的探究实验:
KI在经酸化的溶液中被空气氧化的反应式为:4H++4I﹣+O2=2I2+2H2O.该反应的速率受温度、酸度、溶剂、试剂浓度等影响,可用淀粉与碘的显色反应来观测该反应的速率.已知,淀粉与碘的显色反应在温度升高时灵敏度会降低,高于75℃则不能显色;淀粉浓度越高显色越灵敏、颜色也越深.
实验小组拟用0.8molL﹣1 KI溶液、0.1molL﹣1H2SO4溶液、淀粉溶液等来探究温度、酸度对上述反应速率的影响,他们做了A﹣C三组实验,部分实验数据如下表:
编号 | 温度/℃ | H2SO4体积/mL | KI溶液体积/mL | H2O体积/mL | 淀粉溶液 | 出现蓝色时间/s |
A | 39 | 10 | 5 | 5 | 1 | 5 |
B | TB | 10 | 5 | 5 | 1 | 没出现蓝色 |
C | 5 | 10 | 5 | 5 | 1 | 39 |
D | t |
①为确保A组实验在39℃下进行,应采用的控温操作方法是 .
②A﹣C三组实验时,都加入了5mL水,其目的是 .
③B组实验中“没出现蓝色”,原因是 .
④请你为小组设计D组实验方案(在表格空白处填入你设计的5个数据),以帮助小组完成探究目标.
(3)⑤按你设计的实验数据,请你预测一个t值,并写出与你预测相对应的探究实验结论.
【题目】碘水溶液中存在下列平衡:I2(aq)+I-(aq)=I3-(aq)。测得不同温度下该反应的平衡常数K如表所示,下列说法正确的是
t/℃ | 5 | 15 | 25 | 35 | 50 |
K | 1100 | 841 | 689 | 533 | 409 |
A. 反应I2(aq)+I-(aq)![]() I3-(aq)的ΔH>0
I3-(aq)的ΔH>0
B. 25℃时,向溶液中加入少量KI固体,平衡常数K小于689
C. 其他条件不变,升高温度,溶液中c( I3-)减小
D. 该反应的平衡常数表达式为K=c(I-)/c(I3-)
【题目】氨在工农业生产中应用广泛。在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下表:
温度/℃ | 200 | 300 | 400 | 500 | 600 |
氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
请回答:
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是_______。
(2)在一定温度下,将2molN2和6molH2通入到体积为2L的密闭容器中,发生反应N2+3H2![]() 2NH3,2min达到平衡状态时,H2转化率是50%,该温度下的平衡常数K=_______________(结果用最简分数表示);欲使K增大,可以采取的措施是______。
2NH3,2min达到平衡状态时,H2转化率是50%,该温度下的平衡常数K=_______________(结果用最简分数表示);欲使K增大,可以采取的措施是______。
(3)从化学平衡移动的角度分析,提高H2转化率可以采取的措施是______(选填序号字母)
a.及时分离出NH3 b.升高温度 c.增大压强 d.使用催化剂
(4)NH3能分解为N2和H2,在相同条件下,测得分解后混合气体密度为分解前的2/3,则氨的分解率为_____________。
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
实验编号 | 室温下,试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是__________________________。
(2)利用实验1中的数据,计算用KMnO4表示的化学反应速率为_____________。(溶液混合前后体积变化可忽略)
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。

①该小组同学提出的假设是_____________。
②请你帮助该小组同学完成实验方案,并填写表中空白
实验编号 | 室温下,试管中所加试剂及其用量 | 再向试管中加入某种固体 | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
4 | _____________ | 2.0 | 2.0 | 3.0 | MnSO4 | t |
③若该小组同学提出的假设成立,t_____________1.5(填“大于”、“小于”或“等于”)。