题目内容
14.下列说法中不正确的是( )| A. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| B. | 钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀作用 | |
| C. | 积极开发新能源,如可燃冰、生物汽油等,减少对化石燃料的依赖 | |
| D. | 随着化学的发展,化学实验方法并不是化学研究的唯一手段 |
分析 A、根据聚酯纤维和光导纤维的成分分析;
B、致密的氧化物能保护里面的金属;
C、根据使用化石燃料的害处来分析;
D、化学研究的方法如常规的逻辑方法、模型方法、假说、理论方法、数学方法等.
解答 解:A、制作航天服的聚酯纤维属于有机物,不是无机非金属材料,故A错误;
B、四氧化三铁是致密的能保护内部的钢铁不被腐蚀,故B正确;
C、使用化石燃料会造成严重的空气污染,开发新能源能减少对空气的污染,故C正确;
D、化学研究的方法如常规的逻辑方法、模型方法、假说、理论方法、数学方法等,化学实验方法并不是化学研究的唯一手段,故D正确;
故选A.
点评 本题考查化学的发展趋势、绿色化学等,难度中等,注意化学研究的方法如常规的逻辑方法、模型方法、假说、理论方法、数学方法等.

练习册系列答案
相关题目
4.下列说法正确的是( )
| A. | 三聚氰胺(分子式:C3H6N6)含氮量很高,可作为牛奶添加剂 | |
| B. | 聚氯乙烯能使溴的四氯化碳溶液褪色 | |
| C. | 为了减少“白色污染”,我国规定商家不得提供塑料袋 | |
| D. | 低碳生活就是节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放 |
5.回收利用印刷电路板上的铜制备铜的化合物,实现资源的再利用.
(1)回收利用印刷电路板上的铜制备CuCl2.
实验室模拟回收过程如下:

已知部分物质开始沉淀和沉淀完全时的pH如下表:
请回答下列问题:
①步骤Ⅲ的操作名称是过滤.
②下列试剂中,可以作为试剂a的是C.
A.HNO3溶液 B.Fe2(SO4)3溶液 C.FeCl3溶液
③若不加试剂b,直接加入试剂c调节溶液pH,是否可行?否(填“是”或“否”),理由是不能除去Fe2+,影响所得CuCl2纯度.
(2)用H2O2和硫酸共同浸泡印刷电路板制备硫酸铜.
已知:2H2O2(l)=2H2O (l)+O2(g)△H1=-196kJ/mol
H2O(l)=H2(g)+1/2O2(g)△H2=+286kJ/mol
Cu(s)+H2SO4(aq)=CuSO4(aq)+H2(g)△H3=+64kJ/mol
则Cu(s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O(l)△H=-320KJ/mol.
(3)将反应Cu+H2O2+H2SO4=CuSO4+2H2O设计成原电池,其正极电极反应式是H2O2+2H++2e-=2H2O.
(4)若用硝酸和硫酸共同浸泡印刷电路板制备硫酸铜,假设印刷电路板中其他成分不与酸反应,欲制取3mol纯净的硫酸铜,需要0.5mol/L的硝酸溶液的体积是4L.
(1)回收利用印刷电路板上的铜制备CuCl2.
实验室模拟回收过程如下:

已知部分物质开始沉淀和沉淀完全时的pH如下表:
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Cu(OH)2 | 4.4 | 8.0 |
①步骤Ⅲ的操作名称是过滤.
②下列试剂中,可以作为试剂a的是C.
A.HNO3溶液 B.Fe2(SO4)3溶液 C.FeCl3溶液
③若不加试剂b,直接加入试剂c调节溶液pH,是否可行?否(填“是”或“否”),理由是不能除去Fe2+,影响所得CuCl2纯度.
(2)用H2O2和硫酸共同浸泡印刷电路板制备硫酸铜.
已知:2H2O2(l)=2H2O (l)+O2(g)△H1=-196kJ/mol
H2O(l)=H2(g)+1/2O2(g)△H2=+286kJ/mol
Cu(s)+H2SO4(aq)=CuSO4(aq)+H2(g)△H3=+64kJ/mol
则Cu(s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O(l)△H=-320KJ/mol.
(3)将反应Cu+H2O2+H2SO4=CuSO4+2H2O设计成原电池,其正极电极反应式是H2O2+2H++2e-=2H2O.
(4)若用硝酸和硫酸共同浸泡印刷电路板制备硫酸铜,假设印刷电路板中其他成分不与酸反应,欲制取3mol纯净的硫酸铜,需要0.5mol/L的硝酸溶液的体积是4L.
2.根据表中八种短周期元素的有关信息判断,下列说法错误的是
( )
| 元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径/nm | 0.037 | 0.074 | 0.082 | 0.099 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或 最低化合价 | +1 | -2 | +3 | -1 | -2 | +3 | +1 | +1 |
| A. | 元素②⑥形成的化合物具有两性 | |
| B. | 元素②气态氢化物的沸点小于元素⑤气态氢化物的沸点 | |
| C. | 元素⑤对应的离子半径大于元素⑦对应的离子半径 | |
| D. | 元素④的最高价氧化物的水化物比元素⑤的最高价氧化物的水化物酸性强 |
6.在一定条件下,发生反应:aA(g)+bB(g)?cC(g)△H=Q kJ/mol,其化学平衡常数K和温度的关系如下表所示:
依据图表判断该反应△H<0(填“>”或“<”);若其他条件保持一定,降低温度,该反应物A的转化率增大(填“增大”、“减小”或“不变”,下同),化学反应速率将减小.
| T/℃ | 400 | 500 | 800 | 1 000 |
| K | 2.6 | 1.6 | 1.0 | 0.40 |
3.下列有关二氧化碳的检验、制备和用途能达到目的是( )
| A. | 二氧化碳气体通入紫色石蕊试液中,溶液变蓝 | |
| B. | 将燃着的木条伸入集气瓶,火焰立即熄灭,证明瓶内原有气体就是二氧化碳 | |
| C. | 用块状石灰石和稀硫酸迅速制备大量二氧化碳 | |
| D. | 干冰用于人工降雨 |
4.太阳能电池已为人们所熟悉,制造太阳能电池板的核心体材料是( )


| A. | 二氧化硅 | B. | 硅 | C. | 钛合金 | D. | 铝合金 |
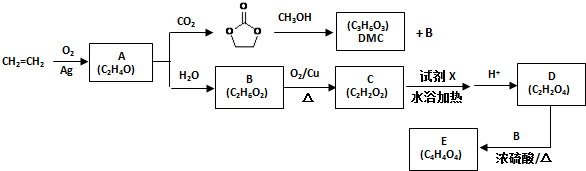
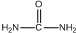 )和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式
)和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式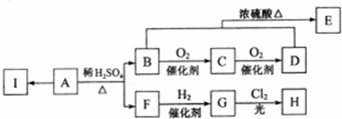
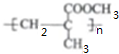 .
.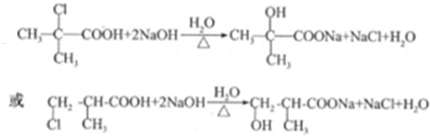 (任写一个)
(任写一个)