题目内容
6.在一定条件下,发生反应:aA(g)+bB(g)?cC(g)△H=Q kJ/mol,其化学平衡常数K和温度的关系如下表所示:| T/℃ | 400 | 500 | 800 | 1 000 |
| K | 2.6 | 1.6 | 1.0 | 0.40 |
分析 由图表数据可知,平衡常数随温度升高减小,说明升温平衡逆向进行,正反应方向为放热反应,降低温度反应正反应方向进行,A的转化率增大,反应速率减小,由此分析解答.
解答 解:由题给图表数据可知,随温度升高,化学平衡常数K减小,所以正反应为放热反应,即△H<0.降低温度,平衡正向移动,A的转化率增大,降低温度,化学反应速率减小,故答案为:<;增大;减小.
点评 本题考查了化学平衡常数的影响因素和分析判断,图表分析和化学平衡移动原理是解题关键,题目难度中等.

练习册系列答案
相关题目
16.下列大小顺序排列不正确的组合是( )
| A. | 气态氢化物的稳定性:HCl>HBr>HI | B. | 离子半径:S2->Na+>O2- | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 熔点:SiO2>NaCl>干冰 |
14.下列说法中不正确的是( )
| A. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| B. | 钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀作用 | |
| C. | 积极开发新能源,如可燃冰、生物汽油等,减少对化石燃料的依赖 | |
| D. | 随着化学的发展,化学实验方法并不是化学研究的唯一手段 |
1.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 高温下,0.2mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| B. | 室温下,1 LpH=13的NaOH溶液中,由水电离出的OH-离子数目为0.1NA | |
| C. | 氢氧燃料电池负极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 2L0.5mol•L-1硫酸钾溶液中阴离子所带电荷数为NA |
18.下列化学用语既能表示一种元素,又能表示一个原子,还能表示一种物质的是( )
| A. | O | B. | Zn | C. | N2 | D. | CO |
15.已知最外层电子数相等的元素原子具有相似的化学性质.下列原子中,与氟原子的化学性质相似的是( )
| A. | C | B. | Ne | C. | Al | D. | Cl |
16.反应2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O可制备高效消毒剂ClO2.对于该反应,下列说法正确的是( )
| A. | H2SO4是氧化剂 | B. | NaClO3被氧化 | C. | ClO2是氧化产物 | D. | Na2SO3是还原剂 |
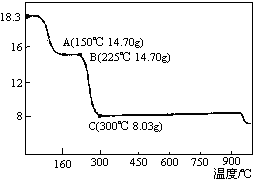 草酸钴是制备钴的氧化物的重要原料.如图为二水合草酸钴(CoC2O4•2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物.
草酸钴是制备钴的氧化物的重要原料.如图为二水合草酸钴(CoC2O4•2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物.
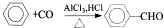
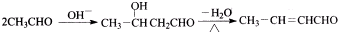
 .
.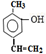 .
.