题目内容
3.下列有关二氧化碳的检验、制备和用途能达到目的是( )| A. | 二氧化碳气体通入紫色石蕊试液中,溶液变蓝 | |
| B. | 将燃着的木条伸入集气瓶,火焰立即熄灭,证明瓶内原有气体就是二氧化碳 | |
| C. | 用块状石灰石和稀硫酸迅速制备大量二氧化碳 | |
| D. | 干冰用于人工降雨 |
分析 A.二氧化碳和水反应生成碳酸,碳酸电离出氢离子而使其溶液呈酸性,酸能使紫色石蕊试液变红色;
B.不支持木条燃烧的气体有二氧化碳、氮气等;
C.石灰石和硫酸反应生成微溶物硫酸钙;
D.干冰汽化时吸收热量而用于人工降雨.
解答 解:A.二氧化碳和水反应生成碳酸,碳酸电离出氢离子而使其溶液呈酸性,酸能使紫色石蕊试液变红色,所以溶液应该是红色而不是蓝色,故A错误;
B.不支持木条燃烧的气体有二氧化碳、氮气等,所以据此现象不能确定气体是二氧化碳,故B错误;
C.石灰石和硫酸反应生成微溶物硫酸钙附着在石灰石表面而阻止进一步反应,应该用稀盐酸和石灰石制取二氧化碳,故C错误;
D.干冰汽化时吸收热量而使水蒸气迅速冷凝生成水滴,从而用于人工降雨,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高考高频点,涉及人工降雨、气体检验、溶液酸碱性判断等知识点,明确物质性质是解本题关键,知道不能用稀硫酸制取二氧化碳的原因,题目难度不大.

练习册系列答案
相关题目
14.下列说法中不正确的是( )
| A. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| B. | 钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀作用 | |
| C. | 积极开发新能源,如可燃冰、生物汽油等,减少对化石燃料的依赖 | |
| D. | 随着化学的发展,化学实验方法并不是化学研究的唯一手段 |
18.下列化学用语既能表示一种元素,又能表示一个原子,还能表示一种物质的是( )
| A. | O | B. | Zn | C. | N2 | D. | CO |
15.已知最外层电子数相等的元素原子具有相似的化学性质.下列原子中,与氟原子的化学性质相似的是( )
| A. | C | B. | Ne | C. | Al | D. | Cl |
12.下列关于物质性质的说法正确的是( )
| A. | 通常状况下,NO2是无色的气体 | |
| B. | SO2能漂白品红等物质,说明SO2有氧化性 | |
| C. | 加热时,铁单质与浓硝酸不发生反应 | |
| D. | 二氧化氯具有强氧化性,可用于自来水的杀菌消毒 |
 .
.
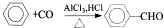
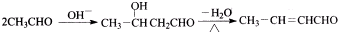
 .
.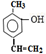 .
.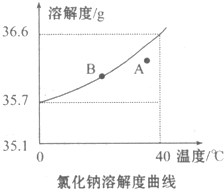 根据氯化钠的溶解度曲线,完成下列问题.
根据氯化钠的溶解度曲线,完成下列问题. 亚硝酸(HN02)在工业上用于有机合成,既具有氧化性又具有还原性,而且氧化性比还原性突出得多.回答下列问题:
亚硝酸(HN02)在工业上用于有机合成,既具有氧化性又具有还原性,而且氧化性比还原性突出得多.回答下列问题: