题目内容
5.Na2S2O3、CuSO4溶液和I-反应生成CuI沉淀和Na2S4O6溶液,已知含碘废液中碘元素的含量为10.33g/L,若回收500mL该含碘废液中的碘,则至少需要2mol/L的硫酸铜溶液多少mL?分析 发生反应方程式为:2S2O32-+2Cu2++2I-=2CuI+S4O62-,结合碘元素守恒和化学方程式中定量关系计算出需要2mol/L的硫酸铜溶液的体积.
解答 解:已知该含碘废液中碘元素的含量为10.33g/L,含碘离子的质量为:0.5L×10.33g/L=5.165g,碘离子的物质的量为:$\frac{5.165g}{127g/mol}$=0.04067mol,
根据反应2S2O32-+2Cu2++2I-=2CuI+S4O62-可知,0.04067mol碘离子至少消耗铜离子的物质的量为0.04067mol,
至少需要2mol/L的硫酸铜溶液体积为:$\frac{0.04067}{2mol/L}$≈0.02034L=20.34mL;
答:至少需要2mol/L的硫酸铜溶液的体积为20.34mL.
点评 本题考查了混合物反应的计算,题目难度中等,正确书写反应的化学方程式为解答关键,注意掌握物质的量与物质的量浓度、摩尔质量等物理量之间的转化关系.

练习册系列答案
相关题目
15.如图是部分短周期主族元素原子半径与原子序数的关系图.下列说法错误的是( )

| A. | X、R的最高化合价相同 | |
| B. | 简单离子的半径:X>Y>Z | |
| C. | Y、X、R对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z |
16.化学与科技、社会、生活密切相关,下列说法不正确的是( )
| A. | 甲醛的水溶液具有杀菌、防腐的作用,可用于保存动物标本 | |
| B. | “地沟油”禁止食用,但可以用来制肥皂或生物柴油 | |
| C. | 在腌制肉类食品时使用较多量的亚硝酸钠,可使食品较长时间保持红润 | |
| D. | 奥运会中采用的新型氢动力计程车可以降低PM2.5的排放,减小大气污染 |
13.下列解释事实的方程式正确的是( )
| A. | 向AgCl沉淀中滴入饱和KI溶液反应的离子方程式:AgCl+I-=AgI+Cl- | |
| B. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 向A1C13溶液中加入过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 向Ca(ClO)2溶液中通入适量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
20.NA表示阿伏加德罗常数的值,下列有关说法正确的是( )
| A. | 反应KIO3+6HI=KI+3H2O+3I2,生成3mol I2转移电子的总数为6NA | |
| B. | 标准状况下,由0.4 mol H2O2生成O2转移的电子数目为0.2NA | |
| C. | 12g石墨和C60的混合物中质子总数为6NA | |
| D. | 室温下,1L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
17.下列有关0.1mol•L-1NaHSO3溶液的叙述正确的是( )
| A. | 该溶液中,K+、NH4+、CH3COOH、S2-可以大量共存 | |
| B. | 和碘水反应的离子方程式:SO32-+I2+H2O=SO42-+2I-+2H+ | |
| C. | 和足量氢氧化钡溶液反应的离子方程式:HSO3-+Ba2++OH-=BaSO3↓+H2O | |
| D. | 1L该溶液和足量稀硝酸充分反应,生成标状况下2.24LSO2 |
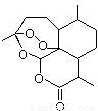
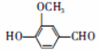 )可用于合成青蒿素,合成天然香草醛的反应如图:
)可用于合成青蒿素,合成天然香草醛的反应如图: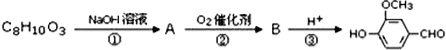
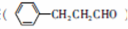 是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。已知:羰基α-H可发生反应:
是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。已知:羰基α-H可发生反应: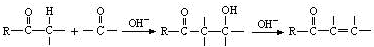
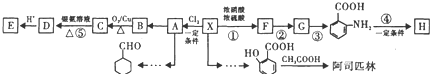
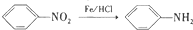 (苯胺、易被氧化)
(苯胺、易被氧化)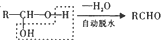
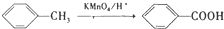
 ;
;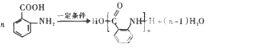 ;
;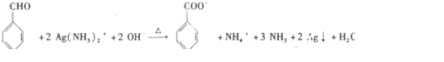 .
.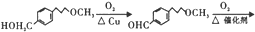 完成
完成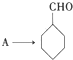 的流程图
的流程图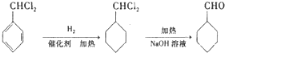 ;
;