��Ŀ����
20���ۺ�����CO2��CO�Թ�����̼�������Ҫ���壮��1��Li4SiO4�����ڸ����õ���Ũ��CO2��ԭ���ǣ���500�棬��Ũ��CO2��Li4SiO4�Ӵ�������������Σ�ƽ��������700�棬��Ӧ������У��ų���Ũ��CO2��Li4SiO4������700��ʱ��Ӧ�Ļ�ѧ����ʽΪLi2CO3+Li2SiO3$\stackrel{700��}{?}$CO2+Li4SiO4��
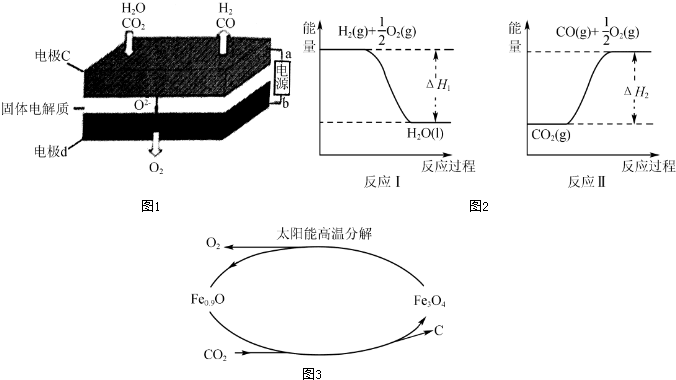
��2��������������أ�SOEC�����ڸ��¹����CO2/H2O���ȿɸ�Ч�Ʊ��ϳ�����CO+H2�����ֿ�ʵ��CO2�ļ��ţ��乤��ԭ����ͼ1��
��bΪ��Դ�����������������������
��д���缫c�����ĵ缫��ӦʽCO2+2e-�TCO+O2-��H2O+2e-=H2+O2-��
��3��������ɵĺϳ����ڴ��������·������·�Ӧ��CO��g��+2H2��g��?CH3OH��g�����Դ˽��������о���ij�¶�����һ��ѹ�����зֱ����1.2molCO��1molH2���ﵽƽ��ʱ�������Ϊ2L���Һ���0.4molCH3OH��g������÷�Ӧƽ�ⳣ��ֵΪ50����ʱ����������ͨ��0.35molCO���壬���ƽ�⽫�淴Ӧ�����ƶ����������Ӧ�������������淴Ӧ������
��4����֪����ͼ2�������״���ȼ����Ϊ��H3�����á�H1����H3��ʾCO��g��+2H2��g��?CH3OH��l���ġ�H����H=2��H1-��H2-��H3��
��5������̫���ܺ�ȱ��������[��Fe0.9O]�ɽ�����CO2�Ƚ�Ϊ̼��������ʵ��CO2����Դ����ת��������ͼ3��ʾ������1molȱ��������[Fe0.9O]������CO2��ȫ��Ӧ������0.1molC��̼����
���� ��1�����������Ϣ����Ӧ��ΪCO2��Li4SiO4����������Li2CO3�����������غ���н��
��2��������̼��ˮ�ֱ���a���õ����ӷ�����ԭ��Ӧ����һ����̼��������ͬʱ���������ӣ��缫b������ʧȥ���ӷ���������Ӧ����������
��3������ƽ�ⳣ���ļ��㹫ʽ���㣬���º�ѹ�£����֮�ȵ������ʵ���֮�ȣ��ݴ˼������0.35molCOʱ����������������ʱŨ���̣���ƽ�ⳣ������жϷ�Ӧ���з���
��4�����ø�˹���ɽ��⣻
��5�����ݷ�Ӧ��Ͳ�������ֱƽ����ƽ��ѧ����ʽ��������֪�غ����õ���
��� �⣺��1����500�棬CO2��Li4SiO4�Ӵ�������Li2CO3����Ӧ��ΪCO2��Li4SiO4����������Li2CO3�����������غ��֪���ﻹ��Li2SiO3������700��ʱ��Ӧ�Ļ�ѧ����ʽΪ��Li2CO3+Li2SiO3$\stackrel{700��}{?}$CO2+Li4SiO4���ʴ�Ϊ��Li2CO3+Li2SiO3$\stackrel{700��}{?}$CO2+Li4SiO4��
��2����CO2+H2O$?_{����}^{���}$CO+H2+O2��������̼�е�̼Ԫ�ػ��ϼ۽��ͣ�����ԭ��ˮ�е���Ԫ�ػ��ϼ۽��ͱ���ԭ����Ӧ���е���Ԫ�ػ��ϼ����ߣ���������ʧȥ���ӷ���������Ӧ�������������Ե缫dΪ����������bΪ��Դ���������ʴ�Ϊ��������
�ڶ�����̼��a���õ����ӷ�����ԭ��Ӧ����һ����̼ͬʱ���������ӣ���Ӧ�缫��ӦʽΪ��CO2+2e-�TCO+O2-��ˮ�е���Ԫ�ػ��ϼ۽��ͱ���ԭ���缫��ӦʽΪ��H2O
+2e-=H2+O2-���ʴ�Ϊ��CO2+2e-�TCO+O2-��H2O+2e-=H2+O2-��
��3��CO��g��+2H2��g��?CH3OH��g��
��ʼ��1.2mol 1mol 0
ת����0.4mol 0.8mol 0.4mol
ƽ�⣺0.8mol 0.2mol 0.4mol
���ԣ�k=$\frac{0.2mol/L}{0.4mol/L����0.1mol/L��^{2}}$=50��mol/L��-2��
��ʱ����������ͨ��0.35molCO���壬����ƽ�ⲻ�ƶ�ʱ����ʱ�������Ϊ��2L��$\frac{��0.35+0.8+0.2+0.4��mol}{��0.8+0.2+0.4��mol}$=2.5L����Ũ����Qc=$\frac{\frac{0.4}{2.5}}{\frac{1.15}{2.5}����\frac{0.2}{2.5}��^{2}}$=54.3������ƽ�ⳣ��50��ƽ�����淴Ӧ�����ƶ���
�ʴ�Ϊ��50���淴Ӧ����
��4����ͼ��Ӧ���֪H2��g��+$\frac{1}{2}$O2��g��=H2O��l������H1���ɷ�Ӧ���֪��CO2��g��=CO��g��+$\frac{1}{2}$O2��g������H2�����״���ȼ����Ϊ��H3������CH3OH��g��+$\frac{3}{2}$O2��g��=2H2O��l��+CO2��g������H3�����Ը�˹���ɣ�Ŀ�귴ӦΪ����H=2��H1-��H2-��H3���ʴ�Ϊ������H=2��H1-��H2-��H3��
��5������ͼʾ�õ���ѧ����ʽΪ��Fe0.9O+0.1CO2=xC+$\frac{0.9}{3}$Fe3O4��
����̼ԭ���غ�õ�x=0.1
�ʴ�Ϊ��0.1��
���� ���⿼�����Ȼ�ѧ����ʽ��˹���ɵļ����Ӧ�ã����ص缫��Ӧ�ķ�����д����ѧƽ�ⳣ���ļ��㣬ԭ���غ�������ԭ��Ӧ�ļ���Ӧ�ã���Ŀ�Ѷ��еȣ�

 ʱ�����������ҵԭ���ܳ�����ϵ�д�
ʱ�����������ҵԭ���ܳ�����ϵ�д�| A�� | ��ˮ�С�Ԫ�ع��硱֮�ƣ��屻��Ϊ������Ԫ�ء� | |
| B�� | ��չ�ȼҵ�����ú�ˮ��һ���������������������H2�ǻ�ԭ���� | |
| C�� | ��ҵ�ϴӺ�ˮ�л�ȡNaCl��AlCl3��ͨ������������οɻ�ý���Na��Al | |
| D�� | ���ú�ˮͨ�������仯���Ի�õ�ˮ��ʳ�Σ����Ӻ�ˮ�л�ȡMgCl2��Br2����ͨ����ѧ�仯 |
| A�� | ��ϵͳ��������������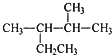 ������Ϊ2-��-3-�һ����� ������Ϊ2-��-3-�һ����� | |
| B�� | �״����Ҵ������ͻ�Ϊͬϵ�� | |
| C�� | �����ʵ�������Ȳ����ȩ��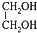 ��ȫȼ��ʱ�ĺ���������� ��ȫȼ��ʱ�ĺ���������� | |
| D�� | ����ϩΪԭ���Ʊ����������ĺϳ�·�߿���Ϊ�� |
| A�� | ������������Դ�Ϳ�������Դ | |
| B�� | ���д�����չ�����ͨ���ٿ�˽�ҳ� | |
| C�� | ���ȼú�����ȼ������ | |
| D�� | ѧУ����ͥ��װ��������װ�� |

| A�� | X��R������ϼ���ͬ | |
| B�� | �����ӵİ뾶��X��Y��Z | |
| C�� | Y��X��R��Ӧ������������ˮ�����֮����Է�����Ӧ | |
| D�� | ������ڵ�X��Z���ɵĻ�������Եõ�����Z |
| A�� | 0.1mol�������к���˫����Ϊ0.3NA | |
| B�� | 1L1mol•L-1̼������Һ�������ӵ���Ŀ����NA | |
| C�� | ��״���£�22.4L�����й����з�����ΪNA | |
| D�� | 50mL18.4mol•L-1Ũ����������ͭ�ȷ�Ӧ��ת�Ƶĵ��ӵ���ĿΪ0.92NA |
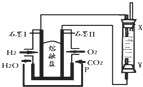 ��H2��O2��������Na2CO3���ȼ�ϵ�أ����õ�ⷨ�Ʊ�Fe��OH��2��װ����ͼ��ʾ������P��ͨ��CO2��ͨ��һ��ʱ����Ҳಣ�����в��������İ�ɫ�������ҽϳ�ʱ�䲻��ɫ��������˵������ȷ���ǣ�������
��H2��O2��������Na2CO3���ȼ�ϵ�أ����õ�ⷨ�Ʊ�Fe��OH��2��װ����ͼ��ʾ������P��ͨ��CO2��ͨ��һ��ʱ����Ҳಣ�����в��������İ�ɫ�������ҽϳ�ʱ�䲻��ɫ��������˵������ȷ���ǣ�������| A�� | X��Y���˶������������缫 | |
| B�� | ��������NaOH��Һ��Ϊ���Һ | |
| C�� | ���������ķ�Ӧ�ǣ�2H2O+2e-=H2��+2OH- | |
| D�� | ��ɫ����ֻ���������ϲ��� |
| A�� | ���ۺ���ά��ˮ������ղ��ﶼ�������� | |
| B�� | ������NaOH��Һ��ȥ���������е��Ҵ� | |
| C�� | ��Ȼ��֬����Ҫ�ɷ��Ǹ�֬���� | |
| D�� | CH��CH��CH2=CHCH=CH2��Ϊͬϵ�� |