题目内容
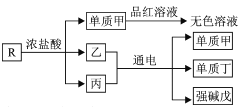
【题目】有机化合物甲、乙、丙的结构如图所示,下列说法正确的是
甲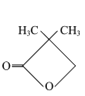 乙
乙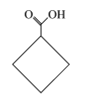 丙
丙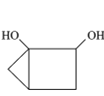
A.三种物质的分子式均为C5H8O2,互为同分异构体
B.甲、乙、丙分子中的所有环上的原子可能共平面
C.三种物质均可以发生氧化反应和加成反应
D.三种物质都能与氢氧化钠溶液发生反应
【答案】A
【解析】
A.分子式相同但结构不同的有机物互为同分异构体,三种物质的分子式均为C5H8O2,但结构不同,则三者互为同分异构体,故A正确;
B.甲、乙、丙分子中的所有环上的碳原子都为单键,碳原子上相连的氢原子和碳原子不在同一平面,故B错误;
C.有机物中含有碳碳双键、碳碳三键、苯环或酮羰基可发生加成反应,甲中官能团为酯基、乙中官能团为羧基、丙中官能团为羟基,不能发生加成反应,甲、乙、丙都可以发生氧化反应,故C错误;
D.甲中有酯基可与氢氧化钠溶液发生水解反应,乙中含有羧基可与氢氧化钠溶液发生中和反应,丙中含有醇羟基不与氢氧化钠溶液反应,故D错误;
答案选A。

练习册系列答案
相关题目
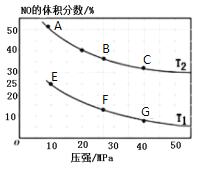
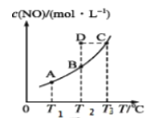
【题目】N2O5在一定温度下可发生反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
4NO2(g)+O2(g) ΔH>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/(mol·L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是( )
A.500s内NO2的生成速率为2.96×10-3mol/(L·s)
B.T1温度下该反应平衡时N2O5的转化率为29.6%
C.平衡后,其他条件不变,将容器体积变为原来的![]() ,则c(N2O5)<5.00mol/L
,则c(N2O5)<5.00mol/L
D.T1、T2温度下的平衡常数分别为K1、K2,若T1>T2,则K1>K2