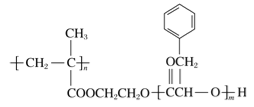
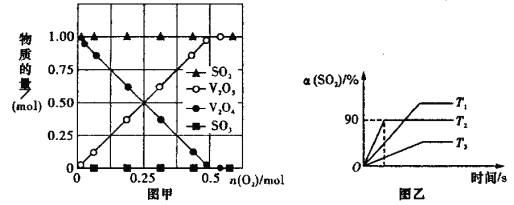
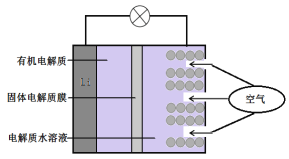
题目内容
【题目】CO2和CH4催化重整可制备合成气,对减缓燃料危机具有重要的意义,其反应历程示意图如下:

下列说法不正确的是
A.合成气的主要成分为CO和H2B.①→②既有碳氧键的断裂,又有碳氧键的形成
C.Ni在该反应中做催化剂D.①→②吸收能量
【答案】D
【解析】
由图可知,CO2和CH4催化重整可制备合成气的方程式:CH4(g)+CO2(g)→2CO+2H2,Ni在该反应中做催化剂,且化学反应中由化学键的断裂和生成,①→②放出能量。
A.CO2和CH4催化重整可制备合成气,则合成气的主要成分为CO和H2,A说法正确;
B.由反应历程图中反应物、生成物可知,①→②既有碳氧键的断裂,又有碳氧键的形成,B说法正确;
C.Ni在该反应中做催化剂,改变反应途径,不改变反应物和生成物,C说法正确;
D.由反应历程示意图可知,反应物所具有的总能量比生成物所具有的总能量高,①→②放出能量,D说法错误;
答案选D

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目