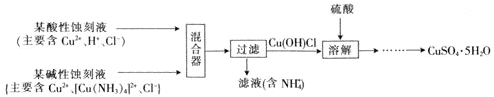
题目内容
【题目】某有机化合物只含C、H、O三种元素,取4.6g该有机化合物完全燃烧,测得只生成0.2molCO2和5.4g水,其质谱图和核磁共振氢谱如图所示,回答下列问题: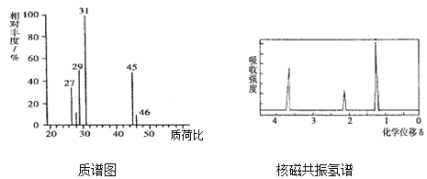
(1)该有机物的相对分子质量为:______________
(2)该有机物的分子式为:______________
(3)该有机物的结构简式为:______________
【答案】46 C2H6O CH3CH2OH
【解析】
有机化合物只含C、H、O三种元素, 4.6g该有机化合物完全燃烧,测得只生成0.2molCO2和5.4g水即0.3mol,则其所含碳元素为2.4g、氢元素为0.6g,则氧元素为4.6g-2.4g-0.6g=1.6g,C、H、O的物质的量之比为2:6:1,则其最简式为C2H6O,由于最简式不饱和度0,则其分子式为C2H6O;据其质谱图和核磁共振氢谱如图所示,可知分子内有3种氢原子,则其结构简式为CH3CH2OH,据此回答;
(1)据分析其分子式为C2H6O,该有机物的相对分子质量为46;答案为:46;
(2)据分析,该有机物的分子式为C2H6O;答案为:C2H6O;
(3)据分析,该有机物的结构简式为CH3CH2OH;答案为:CH3CH2OH 。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
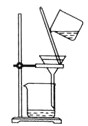
小学生10分钟应用题系列答案【题目】中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸60mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
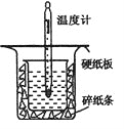
(1)从图中实验装置看,其中尚缺少的一种玻璃用品是_______,除此之外,装置中的一个明显错误是______。
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用在于______。
(3)若改用60mL0.25mol·L-1H2SO4和60mL0.55mol·L-1NaOH溶液进行反应与上述实验相比,所放出的热量____(填“相等”、“不相等”),若实验操作均正确,则所求中和热_____填“相等”“不相等”)
(4)倒入NaOH溶液的正确操作是:______。(从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(5)使硫酸与NaOH溶液混合均匀的正确操作是:______。 (从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(6)实验数据如下表:
①请填写下表中的空白:
温度 实验 次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ______ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55mol/LNaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热ΔH=________(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)______。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
【题目】淮南是我国重要的煤炭生产基地,通过煤的气化和液化,能使煤炭得以更广泛的应用。
I.工业上先将煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
(1)向2L恒容密闭容器中充入CO和H2O(g),800℃时测得部分数据如下表。
t/min | 0 | 1 | 2 | 3 | 4 |
n(H2O)/mol | 1.20 | 1.04 | 0.90 | 0.70 | 0.70 |
n(CO)/mol | 0.80 | 0.64 | 0.50 | 0.30 | 0.30 |
则从反应开始到2min时,用H2表示的反应速率为_________________;该温度下反应的平衡常数K=___________________(小数点后保留1位有效数字)。
(2)相同条件下,向2L恒容密闭容器中充入1molCO、3mol H2O(g)、2molCO2(g)、2mo1 H2(g),此时v正________v逆(填“>” “<” 或 “=”)。
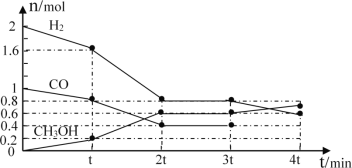
Ⅱ.一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)CH3OH(g)△H=﹣105kJmol﹣1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如右图中Ⅰ、Ⅱ、Ⅲ曲线所示:
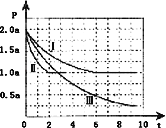
(1)Ⅱ和Ⅰ相比,改变的反应条件是______.
(2)反应Ⅰ在6min时达到平衡,在此条件下从反应开始到达到平衡时v(CH3OH)=______.
(3)反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ)=______.
(4)比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1_____T3(填“>”“<”“=”),判断的理由是_________________________________________________________.
【题目】相同温度下,体积均为0.25 L的两个密闭容器中发生反应:X2(g)+3Y2(g) ![]() 2XY3(g) ΔH=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:
2XY3(g) ΔH=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:
起始时各物质物质的量/mol | 达平衡时体系能量的变化 | |||
容器 | X2 | Y2 | XY3 | |
容器①恒温恒容 | 1 | 3 | 0 | 放热 23.15 kJ |
容器②恒温恒压 | 1 | 3 | 0 | Q(Q>0) |
下列叙述正确的是( )
A. 容器①、②中反应物X2的转化率相同
B. 达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
C. 容器①、②达到平衡时间相同
D. 容器②, Q大于23.15 kJ