题目内容
【题目】淮南是我国重要的煤炭生产基地,通过煤的气化和液化,能使煤炭得以更广泛的应用。
I.工业上先将煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
(1)向2L恒容密闭容器中充入CO和H2O(g),800℃时测得部分数据如下表。
t/min | 0 | 1 | 2 | 3 | 4 |
n(H2O)/mol | 1.20 | 1.04 | 0.90 | 0.70 | 0.70 |
n(CO)/mol | 0.80 | 0.64 | 0.50 | 0.30 | 0.30 |
则从反应开始到2min时,用H2表示的反应速率为_________________;该温度下反应的平衡常数K=___________________(小数点后保留1位有效数字)。
(2)相同条件下,向2L恒容密闭容器中充入1molCO、3mol H2O(g)、2molCO2(g)、2mo1 H2(g),此时v正________v逆(填“>” “<” 或 “=”)。
Ⅱ.一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)CH3OH(g)△H=﹣105kJmol﹣1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如右图中Ⅰ、Ⅱ、Ⅲ曲线所示:
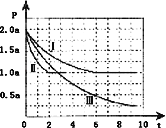
(1)Ⅱ和Ⅰ相比,改变的反应条件是______.
(2)反应Ⅰ在6min时达到平衡,在此条件下从反应开始到达到平衡时v(CH3OH)=______.
(3)反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ)=______.
(4)比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1_____T3(填“>”“<”“=”),判断的理由是_________________________________________________________.
【答案】 0.075molL-1min-1 1.2 < Ⅱ中使用催化剂 0.125 mol/(Lmin) 12 > 此反应为放热反应,降低温度,反应速率减慢,平衡向正反应方向移动
【解析】I.(1)从反应开始到2min时,△n(H2O)=0.3mol,则生成0.3mol氢气, v(H2)=0.3mol/(2L·2min)=0.075mol·L1·min1;根据已知表格信息,列出三段式:
CO(g)+H2O(g) CO2(g)+H2(g)
起始n/mol 0.80 1.20 0 0
△n/mol 0.50 0.50 0.50 0.50
平衡n/mol 0.30 0.70 0.50 0.50
容器体积为2L,则K= =1.2
=1.2
(2)向2L恒容容器中充入1molCO、3molH2O、2molCO2、2molH2,Qc= =
=![]() >1.2,平衡向逆反应方向进行,所以υ(正)<υ(逆)。故答案为:<;
>1.2,平衡向逆反应方向进行,所以υ(正)<υ(逆)。故答案为:<;
Ⅱ. ①Ⅱ和Ⅰ相比反应速率加快,不影响平衡移动,正反应为气体物质的量减小的反应,应是使用催化剂;故答案为:Ⅱ中使用催化剂;
②根据pV=nRT可知,恒温恒容下,压强之比等于气体物质的量之比。反应Ⅰ起始状态时压强为2kPa,平衡时压强为1kPa。则平衡时气体的物质的量为起始时气体物质的量的2倍。设CO转化xmol,列三段式:
CO(g)+2H2(g)CH3OH(g)
起始量(mol): 2 4 0
变化量(mol): ![]() 2
2![]()
![]()
平衡量(mol): 2- ![]() 4-2
4-2![]()
![]()
所以, ![]() =2,解得
=2,解得![]() =1.5
=1.5
则v(CH3OH)=1.5mol/(2L·6min)=0.125mol/(L·min),故答案为:0.125mol/(L·min);
③Ⅱ、Ⅰ温度相同,平衡常数相同,平衡常数K(Ⅱ)=K(Ⅰ)=  ;故答案为:12;
;故答案为:12;
④反应Ⅲ达平衡时所用的时间比反应Ⅰ达平衡时所用的时间长,化学反应速率快,且Ⅲ平衡时压强比I小,与I相比平衡正向移动,正反应为气体体积减小放热反应,应降低温度,故温度T1温度更高,故答案为:>;此反应为放热反应,降低温度,反应速率减慢,平衡向正反应方向移动。

 优百分课时互动系列答案
优百分课时互动系列答案