题目内容
【题目】对于可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,下列研究目的和示意图相符的是( )
2NH3(g) ΔH<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
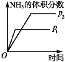
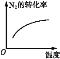
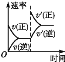
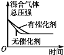
研究目的 | 压强对反应的影响(p2>p1) | 温度对反应的影响 | 平衡体系中增加N2的浓度对反应的影响 | 催化剂对反应的影响 |
示意图 |
|
|
|
|
A. AB. BC. CD. D
【答案】C
【解析】
A.增大压强,化学反应速率加快,达到平衡所需要的时间更少,P1>P2,选项A错误;
B.升高温度,化学平衡向吸热反应方向即向逆反应方向移动,N2的转化率降低,选项B错误;
C.平衡体系中增加N2的浓度。在这一瞬间,反应物的浓度突然增大,生成物的浓度不变,所以v(正)>v(逆),化学平衡向正反应方向移动,直至达到新的平衡,选项C正确;
D.加入催化剂,由于改变了反应途径,化学反应速率大大加快,缩短了达到平衡所需要的时间,选项D错误;
答案选C。

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目