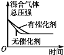
题目内容
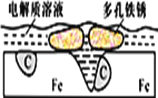
【题目】为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。

活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应。
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是___。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择___(填字母编号)。
A.KMnO4溶液 B.K3[Fe(CN)6]溶液 C.KSCN溶液
(3)在反应FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4中,有7molFe2(SO4)3参与反应,有__电子转移;
(4)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2=Fe +2Li2S,正极反应式是___。
(5)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。FeCO3在空气中加热反应生成Fe2O3的化学方程式是___。
【答案】Fe2O3+6H+=2Fe3++3H2O C 14mol FeS2+4e-=Fe +2S2- 4FeCO3+O2![]() 2Fe2O3+4CO2
2Fe2O3+4CO2
【解析】
硫铁矿烧渣用硫酸浸取,过滤后滤液中含有硫酸铁、未反应的硫酸,用活化硫铁矿还原Fe3+后过滤,向滤液中加入FeCO3调节溶液pH,过滤后再通入空气、调节溶液pH,除去溶液中杂质离子,过滤浓缩结晶得到FeSO4晶体。
(1)H2SO4与Fe2O3反应生成硫酸铁与水,反应离子方程式为:Fe2O3+6H+=2Fe3++3H2O;
(2) 检验第Ⅱ步中Fe3+是否完全还原,即检验还原后的溶液中是否存在Fe3+;KMnO4溶液、K3[Fe(CN)6]溶液可以检验有Fe2+生成,而KSCN溶液用于检验Fe3+,操作为:取第Ⅱ步反应中溶液少许于试管中,滴加KSCN 溶液,若溶液不变红色,说明Fe3+完全被还原,故答案为:C;
(3)FeS2+7Fe2(SO4)3+8H2O═15FeSO4+8H2SO4中,FeS2中S元素的化合价由-1价升高为+6价,Fe2(SO4)3中Fe元素的化合价由+3价降低为+2价,由反应可知,有7molFe2(SO4)3参与反应时转移14mol电子;
(4)电池放电时的总反应为:4Li+FeS2=Fe+2Li2S,正极发生还原反应,FeS2获得电子生成Fe、S2-,正极电极反应式为:FeS2+4e-=Fe+2S2-;
(5)FeCO3在空气中加热反应生成Fe2O3的化学方程式是4FeCO3+O2![]() 2Fe2O3+4CO2。
2Fe2O3+4CO2。

【题目】对于可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,下列研究目的和示意图相符的是( )
2NH3(g) ΔH<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响(p2>p1) | 温度对反应的影响 | 平衡体系中增加N2的浓度对反应的影响 | 催化剂对反应的影响 |
示意图 |
|
|
|
|
A. AB. BC. CD. D