题目内容
【题目】![]() 时,
时,![]() 的
的![]() ,
,![]() ,室温下向10mL
,室温下向10mL![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液,如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象
溶液,如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象![]() 因有逸出未画出
因有逸出未画出![]() 。下列说法错误的是
。下列说法错误的是![]()
A.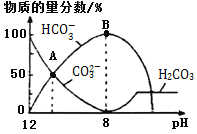
A点所示溶液的![]()
B.B点所示溶液:![]()
C.A点![]() 点发生反应的离子方程式为
点发生反应的离子方程式为![]()
D.Na2CO3溶液中,c(Na+)+c(H+)=2C(CO32-)+c(![]() )+c(OH-)
)+c(OH-)
【答案】B
【解析】
A.A点c(HCO3-)=c(CO32-),Ka2=![]() =5.6×10-11,则c(H+)=5.6×10-11mol·L-1,所以pH<11,故A正确;
=5.6×10-11,则c(H+)=5.6×10-11mol·L-1,所以pH<11,故A正确;
B.室温下向10mL 0.1mol·L-1Na2CO3溶液中逐滴加入0.1mol·L-1HCl溶液,B点溶液中钠离子的物质的量浓度是含碳粒子的浓度的2倍,即c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3),故B错误;
C.A点→B:CO32-逐渐减少,HCO3-逐渐增加,所以发生反应的离子方程式为CO32-+H+=HCO3-,故C正确;
D.Na2CO3溶液中,根据电荷守恒:c(Na+)+c(H+)=2C(CO32-)+c(![]() )+c(OH-),故D正确;
)+c(OH-),故D正确;
故选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
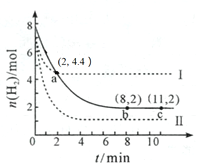
【题目】对于可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,下列研究目的和示意图相符的是( )
2NH3(g) ΔH<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响(p2>p1) | 温度对反应的影响 | 平衡体系中增加N2的浓度对反应的影响 | 催化剂对反应的影响 |
示意图 |
|
|
|
|
A. AB. BC. CD. D