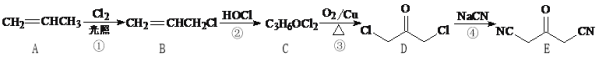题目内容
【题目】运用有关概念判断下列叙述正确的是( )
A.1mol H2燃烧放出的热量为H2的燃烧热
B.Na2SO3和H2O2的反应为氧化还原反应
C.![]() 和
和![]() 互为同系物
互为同系物
D.BaSO4的水溶液不导电,故BaSO4是弱电解质
【答案】B
【解析】
A、燃烧热的概念中除了强调1mol可燃物,还要强调在在25℃、101kPa时完全燃烧,生成稳定的氧化物,H2应该生成H2O(l),而非H2O(g),现在题目未指明状态,A项错误;
B、Na2SO3+H2O2=Na2SO4+H2O是氧化还原反应,B项正确;
C、苯酚与苯甲醇虽官能团均是羟基,但性质不同,种类不同,一个是酚羟基,一个是醇羟基,C项错误;
D、BaSO4难溶于水,故水溶液不导电,但在熔融状态可完全电离而可导电,是强电解质;
故选B。

【题目】下列物质发生变化时,所克服的粒子间相互作用属同种类型的是( )
A.亚硫酸氢钠和硫酸氢钠分别溶解在水中
B.硝酸铵与硝酸分别受热变为气体
C.氯化钠与氯化氢分别溶解在水中
D.碘与干冰分别受热变为气体
【题目】苯乙烯(![]() )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
![]() (g)
(g)![]()
![]() (g)+H2(g) △H
(g)+H2(g) △H
(1)已知:
化学键 | C-H | C-C | C=C | H-H |
键能/kJ/mol | 412 | 348 | 612 | 436 |
计算上述反应的△H=________ kJ·mol-1。
(2)500℃时,在恒容密闭容器中,充入a mol乙苯,反应达到平衡后容器内气体的压强为P;若再充入bmol的乙苯,重新达到平衡后容器内气体的压强为2P,则a_______b(填“>” “<”或“=”),乙苯的转化率将________(填“增大” “减小”或“不变”)。
(3)工业上,通常在乙苯(EB)蒸气中掺混N2(原料气中乙苯和N2的物质的量之比为1︰10,N2不参与反应),控制反应温度600℃,并保持体系总压为0.1Mpa不变的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
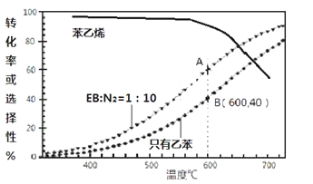
①A,B两点对应的正反应速率较大的是________。
②掺入N2能提高乙苯的平衡转化率,解释说明该事实___________________________。
③用平衡分压代替平衡浓度计算600℃时的平衡常数Kp=________。(保留两位有效数字,分压=总压×物质的量分数)
④控制反应温度为600℃的理由是___________________________。