题目内容
【题目】把一块镁铝合金投入到1mol/L盐酸里,待合金完全溶解后,往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图A所示。下列说法中不正确的是( )

A.a的取值范围为0≤a<50
B.![]() 的最大值为2.5
的最大值为2.5
C.若将关系图改为B图时,则a的取值范围为80<a<90
D.若将关系图改为C图时,则a的取值范围为75<a<90
【答案】C
【解析】
根据图可知,0→a:H++OH-=H2O、a→80:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,最后80→90:是Al(OH)3的溶解过程,Al(OH)3+OH-=AlO2-+2H2O,从横坐标80mL到90mL这段可以求出n(NaOH)=1mol/L![]() 0.01L=0.01mol,根据反应可知,n[Al(OH)3]=0.01mol,则n(Al)=n[Al(OH)3]=0.01mol,所以Al3+消耗的NaOH溶液的体积为(0.01mol×3)÷1mol/L=0.03L=30mL,据此进行解答。
0.01L=0.01mol,根据反应可知,n[Al(OH)3]=0.01mol,则n(Al)=n[Al(OH)3]=0.01mol,所以Al3+消耗的NaOH溶液的体积为(0.01mol×3)÷1mol/L=0.03L=30mL,据此进行解答。
A.假设合金完全溶解在盐酸中没有H+剩余,则a=0;假设溶液中没有Mg2+,仅有Al3+,则a取最大值,Al3+消耗的NaOH溶液的体积为30mL,a=(80-30)mL=50mL,因是镁铝合金参与反应,则a的取值范围为0≤a<50,A项正确;
B.由上述分析可知n(Al3+)=0.01mol,第四阶段无反应,沉淀全为Mg(OH)2,若a=0,n(Mg2+)取得最大值,第一阶段,和Al3+反应的NaOH为30mL,所以此时和Mg2+反应的NaOH为(80-30)mL=50mL,则此时消耗的氢氧化钠的物质的量为1mol/L![]() 0.05L=0.05mol,故n(Mg2+)max=
0.05L=0.05mol,故n(Mg2+)max=![]()
![]() 0.05mol=0.025mol,所以
0.05mol=0.025mol,所以![]() 的最大值为
的最大值为![]() =2.5,B项正确;
=2.5,B项正确;
C. 若将关系图改为B图时,同样的原理可知,假设溶液中没有Mg2+,仅有Al3+,则此时a取最大值,n(Al3+)=![]() ,则n[Al(OH)3]=n(Al3+)=
,则n[Al(OH)3]=n(Al3+)=![]() ,故此阶段消耗的氢氧化钠的体积为
,故此阶段消耗的氢氧化钠的体积为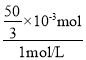 =
=![]() =
=![]() mL,则amax=(80+
mL,则amax=(80+![]() ) mL
) mL![]() 96.7mL,故a的取值范围为80<a<96.7,C项错误;
96.7mL,故a的取值范围为80<a<96.7,C项错误;
D. 若将关系图改为C图时,同样的原理可知,假设溶液中没有Mg2+,仅有Al3+,a取最小值,沉淀0.1mol铝元素需要0.3mol NaOH,溶解该沉淀则需要0.1mol NaOH,则(a-30)mL=3(90-a)mL,解得a=75,故a的取值范围为75<a<90,D项正确;
答案选C。

 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案